

Ứng dụng AI cho ung thư gan là gì
Ứng dụng Ai cho ung thư gan là dùng thuật toán AI và kỹ thuật học máy để hỗ trợ nhiều khía cạnh trong mục tiêu phát hiện, chẩn đoán, điều trị và quản lý ung thư gan.
Các ứng dụng AI cho ung thư gan phân tích dữ liệu y tế như hình ảnh chụp chiếu, thông tin di truyền và hồ sơ lâm sàng để xác định ung thư ở giai đoạn sớm, dự đoán nguy cơ của bệnh nhân, cá nhân hóa kế hoạch điều trị, theo dõi phản ứng điều trị và đẩy nhanh nghiên cứu các liệu pháp mới.
AI giúp các chuyên gia chăm sóc sức khỏe đưa ra quyết định chính xác hơn, tối ưu hóa kết quả điều trị cho bệnh nhân và nâng cao hiệu quả tổng thể của việc chăm sóc ung thư gan.
Cơ chế kỹ thuật
Radiomics: Giải mã đặc điểm hình ảnh
Chẩn đoán hình ảnh y tế truyền thống dựa vào đánh giá định tính.
Bác sĩ X quang quan sát các hình ảnh CT hoặc MRI để phát hiện tổn thương nghi ngờ dựa trên đặc điểm hình thái.
Phương pháp này có giá trị nhưng chỉ khai thác được một phần nhỏ thông tin ẩn chứa trong ảnh y tế.
Radiomics giải quyết hạn chế căn bản khi chuyển đổi hình ảnh y tế số thành dữ liệu định lượng đa chiều.
Nó dựa trên giả thuyết hình ảnh chứa thông tin bệnh sinh lý mà mắt thường không thể phát hiện.
Khả năng này đặc biệt quan trọng với ung thư gan (HCC), vì tính không đồng nhất của khối u liên quan trực tiếp đến mức độ ác tính sinh học, đáp ứng điều trị và tiên lượng bệnh nhân.
Ví dụ: Tại Bệnh viện K, hệ thống radiomics đã được thử nghiệm trên hơn 500 ca HCC, giúp phát hiện các vi u tổn (<2cm) mà chẩn đoán hình ảnh thông thường thường bỏ sót.
Kết quả cho thấy độ chính xác tăng từ 76% (đọc phim thủ công) lên 89% khi kết hợp với phân tích radiomics tự động.
Quy trình radiomics cho ung thư gan tuân theo ba giai đoạn hệ thống.
Giai đoạn 1 – Phân đoạn vùng quan tâm (ROI)
- Xác định chính xác khối u gan trên chuỗi ảnh CT hoặc MRI.
- Thuật toán AI, đặc biệt là kiến trúc U-Net, đã tự động hóa bước này với độ chính xác vượt 90%.
- Do đó loại bỏ sự khác biệt giữa các bác sĩ khi phân đoạn thủ công.
Giai đoạn 2 – Trích xuất đặc trưng
- Tạo ra hàng trăm đến hàng nghìn chỉ số định lượng từ ROI.
- Đặc trưng hình dạng: Thể tích, diện tích bề mặt, độ cầu, độ đặc, phản ánh kiểu tăng trưởng u
- Thống kê bậc nhất: Biểu đồ cường độ, trung bình, trung vị, độ lệch chuẩn – mô tả mật độ tổng thể của mô
Giai đoạn 3 – Đặc trưng kết cấu (quan trọng nhất)
- Được tính từ các ma trận như Gray-Level Co-occurrence Matrix (GLCM) hoặc Gray-Level Run Length Matrix (GLRLM)
- Các bộ mô tả kết cấu này định lượng sự sắp xếp không gian của cường độ điểm ảnh, tiết lộ tính không đồng nhất nội u.
- Đây là yếu tố có mối tương quan mạnh với mức độ ác tính, hoại tử u và mô hình tưới máu mạch.
Ví dụ: Tại Bệnh viện, một bệnh nhân HCC có khối u 3.5cm trên CT cho thấy các đặc trưng GLCM (entropy = 7.8, contrast = 245) chỉ báo độ không đồng nhất cao.
Khi so sánh với ngân hàng dữ liệu 1,200 ca, hệ thống dự đoán xâm lấn vi mạch với xác suất 84%, phù hợp với kết quả mô bệnh học sau phẫu thuật.
Giá trị lâm sàng mở rộng từ phân loại đến radiogenomics, liên kết đặc điểm hình ảnh với hồ sơ phân tử.
Các nghiên cứu đã chứng minh mối tương quan giữa đặc trưng radiomics từ CT với biểu hiện gen như VEGF (tạo mạch máu), KRT19 (dấu ấn tiên lượng xấu), và đột biến CTNNB1.
Do đó tạo ra “sinh thiết ảo” – đánh giá toàn diện không xâm lấn về sinh học phân tử u mà không cần lấy mẫu mô.
Ứng dụng trong phẫu thuật: Với bệnh nhân đủ tiêu chuẩn phẫu thuật, mô hình radiomics dự đoán xâm lấn vi mạch (MVI) với AUC đạt 0.82, trực tiếp hỗ trợ quyết định về ranh giới cắt và điều trị bổ trợ.
Năm 2024, một nghiên cứu trên 320 bệnh nhân cho thấy radiomics giúp giảm 28% số ca sinh thiết không cần thiết.
Hơn nữa cung cấp thông tin tiên lượng chính xác hơn so với đánh giá hình ảnh thông thường, giúp các bác sĩ lập kế hoạch điều trị cá nhân hóa hiệu quả hơn.
Phương pháp định lượng này chuyển đổi đọc phim chủ quan thành các dấu ấn sinh học có thể tái lập, chuẩn hóa cho lập kế hoạch điều trị.
Pathomics: Hiện đại hóa giải phấu bệnh
Giải phẫu bệnh vẫn là tiêu chuẩn vàng để chẩn đoán xác định HCC.
Tuy nhiên đánh giá kính hiển vi truyền thống gặp hạn chế về thời gian, sự khác biệt giữa các bác sĩ và không thể định lượng các mô hình hình thái tinh vi.
Đánh giá hình ảnh tiêu bản toàn bộ (WSI) chứa hàng tỷ điểm ảnh đòi hỏi nhiều giờ chuyên gia, tạo ra tắc nghẽn trong quy trình chẩn đoán.
Pathomics ứng dụng deep learning để phân tích tiêu bản mô số hóa một cách có hệ thống.
Vì vậy trích xuất đặc trưng định lượng từ kiến trúc tế bào vượt quá khả năng nhận thức của con người.
Ví dụ: Tại Bệnh viện Ung Bướu, mỗi bác sĩ giải phẫu bệnh phải đọc trung bình 80-100 tiêu bản mỗi ngày. Một tiêu bản WSI kích thước 15GB có thể mất 15-20 phút để đánh giá kỹ.
Hệ thống pathomics giúp rút ngắn thời gian sơ loại xuống 3-5 phút, đồng thời cảnh báo các vùng nghi ngờ cần bác sĩ kiểm tra kỹ.
Mạng nơ-ron tích chập (CNN) được huấn luyện trên hàng triệu mảnh ảnh trích từ WSI, học các biểu diễn phân cấp về cấu trúc tế bào, hình thái nhân và mô hình stroma.
Mạng sử dụng transfer learning từ cơ sở dữ liệu hình ảnh quy mô lớn, sau đó tinh chỉnh trên bộ dữ liệu giải phẫu gan có chú thích.
Quy trình xử lý:
- Tiền xử lý: WSI được chia thành patches 256×256 pixels với overlap 50%
- Trích xuất đặc trưng: CNN đa lớp (thường dùng ResNet-50 hoặc EfficientNet) phân tích từng patch
- Tổng hợp: Kết hợp thông tin từ tất cả patches tạo bản đồ xác suất cho các hạng mục chẩn đoán
- Attention mechanism: Xác định vùng có giá trị chẩn đoán cao nhất, mô phỏng cách bác sĩ quét tiêu bản
Ví dụ: Hệ thống tại Viện Pháp y sử dụng mô hình Inception-v4 với 48 triệu tham số, được huấn luyện trên 12,000 WSI từ 8 bệnh viện lớn.
Mô hình phát hiện 5 cấp độ: gan bình thường, xơ gan, nốt loạn sản, HCC phân hóa tốt và HCC phân hóa kém.
AI đạt độ chính xác chẩn đoán đáng kể khi một nghiên cứu đa trung tâm cho thấy mô hình deep learning đạt AUC 0.93 trong phân biệt gan bình thường, mô xơ gan, nốt loạn sản và HCC phân hóa tốt.
Nó vượt trội so với 9 bác sĩ giải phẫu bệnh tham gia.
Pathomics dự đoán các đặc điểm tiên lượng:
- Xâm lấn vi mạch (MVI): Mô hình nhận diện MVI từ tiêu bản H&E thông thường với độ chính xác 86%, không cần quy trình nhuộm hóa mô miễn dịch phức tạp
- Tế bào lympho thâm nhiễm u (TILs): AI định lượng TILs để dự đoán đáp ứng miễn dịch trị liệu, cung cấp thông tin hữu ích cho lựa chọn điều trị
Ví dụ: Trong quý 1/2025, hệ thống pathomics đã phân tích 450 ca HCC, phát hiện được 23 ca MVI mà đánh giá thủ công ban đầu bỏ sót.
Vì vậy giúp điều chỉnh phác đồ điều trị kịp thời, cải thiện tỷ lệ sống sau 2 năm từ 58% lên 67% ở nhóm này.
Phương pháp giải phẫu bệnh tính toán chuẩn hóa đánh giá, giảm thời gian xử lý.
Sau đó trích xuất thông tin tiên lượng từ tiêu bản mô thường quy mà trước đây cần xét nghiệm chuyên biệt.
Tích hợp đa mô thức
Mô hình AI đơn mô thức chỉ sử dụng hình ảnh hoặc chỉ genomics gặp hạn chế vốn có trong việc nắm bắt toàn bộ độ phức tạp của sinh học ung thư gan.
HCC phát sinh từ tương tác phức tạp giữa thay đổi di truyền, vi môi trường miễn dịch, kiến trúc mạch máu và các yếu tố lâm sàng như chức năng gan.
Cách tiếp cận đơn mô thức không thể biểu diễn đầy đủ bức tranh bệnh đa chiều này nên tạo ra giới hạn trần về độ chính xác dự đoán.
Tích hợp đa mô thức giải quyết khó khăn này khi kết hợp radiomics, pathomics, genomics và dữ liệu lâm sàng vào khung tính toán thống nhất.
Ví dụ: Bệnh viện K triển khai mô hình tích hợp sử dụng CT (từ Phòng Chẩn đoán Hình ảnh), kết quả sinh thiết số hóa (từ Khoa Giải phẫu Bệnh), xét nghiệm gen (gửi Singapore/Thái Lan) và dữ liệu lâm sàng từ HIS.
Trước đây, các bác sĩ phải tự tổng hợp thủ công, mất 2-3 ngày.
Hiện hệ thống tự động tích hợp trong 4 giờ, đưa ra báo cáo tiên lượng tổng hợp.
Kiến trúc đa mô thức hiện đại sử dụng chiến lược fusion ở nhiều mức:
- Early Fusion (Fusion sớm): Nối các đặc trưng từ tất cả mô thức trước khi huấn luyện mô hình, tạo vector đầu vào toàn diện.
- Late Fusion (Fusion muộn): Huấn luyện mô hình riêng cho từng loại dữ liệu, sau đó kết hợp dự đoán thông qua phương pháp ensemble hoặc meta-learning.
- Attention-based Fusion (Fusion dựa attention): Mô hình tự động cân đối các mô thức khác nhau dựa trên mức độ liên quan cho từng dự đoán cụ thể.
Một mô hình radiogenomics tích hợp:
- Nhánh 1 – Imaging: Đặc trưng kết cấu CT (512 features từ GLCM, GLRLM, wavelet transforms)
- Nhánh 2 – Genomics: Dữ liệu single-cell RNA sequencing (scRNA-seq) mô tả quần thể tế bào miễn dịch (30,000 genes)
- Nhánh 3 – Clinical: Biến số lâm sàng (nồng độ AFP, điểm Child-Pugh, kích thước u, số lượng u)
Các nhánh này được xử lý qua mạng nơ-ron đa đầu (multi-headed neural networks) học sơ đồ trọng số tối ưu trong quá trình huấn luyện.
Mô hình đa mô thức cho hiệu suất vượt trội trên các điểm đánh giá lâm sàng.
Một khung radiogenomics kết hợp scRNA-seq với đặc trưng CT đạt AUC 0.85 cho dự đoán sống còn.
Vì thế vượt đáng kể so với chỉ dùng hình ảnh (AUC 0.74) hoặc chỉ genomics (AUC 0.78).
Quan trọng hơn, các mô hình này cung cấp thông tin về cơ chế khi phân tích đặc trưng nào điều khiển dự đoán.
Từ đó các nhà nghiên cứu làm sáng tỏ mối quan hệ giữa kiểu hình hình ảnh và thành phần vi môi trường u.
Ví dụ: Các mô hình radiomics đặc hiệu tương quan với thâm nhiễm tế bào T điều hòa và đại thực bào M2, giải thích đáp ứng khác nhau với thuốc ức chế điểm kiểm tra miễn dịch.
So với phân tầng truyền thống (chỉ dựa Barcelona Clinic Liver Cancer staging), cách tiếp cận này cải thiện độ chính xác tiên lượng 23%.
Do đó giúp tối ưu hóa nguồn lực điều trị và cải thiện kết quả bệnh nhân.
Phương pháp tích hợp tạo ra phân tầng rủi ro chính xác.
Vì vậy ghép bệnh nhân với cường độ điều trị phù hợp đồng thời tiết lộ mối quan hệ sinh học giữa dấu ấn sinh học hình ảnh và cơ chế phân tử.
Ứng dụng lâm sàng
Sàng lọc và phát hiện sớm
Phát hiện ung thư biểu mô tế bào gan (HCC) ở giai đoạn sớm đóng vai trò quyết định đến khả năng sống sót của bệnh nhân.
Các phương pháp điều trị triệt để như cắt bỏ gan hoặc ghép gan chỉ khả thi khi khối u được tìm thấy trước khi tiến triển xa.
Vì vậy, hiệu quả của tầm soát trở thành yếu tố then chốt để giảm tỷ lệ tử vong ở quy mô dân số.
Siêu âm mặc dù là phương pháp tầm soát chính nhờ dễ tiếp cận và chi phí hợp lý nhưng vẫn phụ thuộc rất nhiều vào tay nghề của người thực hiện.
Điều này tạo ra sự chênh lệch đáng kể trong tỷ lệ phát hiện bệnh.
Hạn chế sẽ càng rõ rệt khi khám gan xơ hóa, nơi cấu trúc mô bị biến dạng khiến các tổn thương nhỏ khó nhận biết.
Hệ thống siêu âm tích hợp AI khắc phục điểm yếu này thông qua thuật toán tự động phát hiện tổn thương dựa trên kiến trúc Deep Learning.
Các hệ thống phân tích hình ảnh theo thời gian thực để nhận diện tổn thương khu trú ở gan với độ nhạy cao.
Do đó giảm đáng kể tỷ lệ âm tính giả – vấn đề thường xảy ra trong tầm soát thông thường.
Ví dụ: Tại Trung Quốc, hệ thống PANDA đã triển khai công nghệ này ở quy mô lớn. Hệ thống đã phát hiện nhiều ca ung thư giai đoạn sớm mà các bác sĩ X quang bỏ lỡ trong lần đọc kết quả đầu tiên.
Điều này chứng minh AI có thể hoạt động như lưới an toàn đáng tin cậy trong môi trường tầm soát thiếu nguồn lực, nơi chuyên môn y tế còn hạn chế.
Ngoài hình ảnh học, kết hợp các chỉ dấu sinh học huyết thanh là lĩnh vực tiên phong khác mà AI đang nâng cao khả năng phát hiện sớm.
Các dấu ấn sinh học đơn lẻ trong máu như alpha-fetoprotein (AFP) không đủ độ nhạy khi sử dụng riêng lẻ, bỏ sót tới 40% ca HCC giai đoạn sớm.
Thuật toán AI vượt qua giới hạn khi kết hợp nhiều chỉ dấu sinh học thành điểm dự đoán nguy cơ phức hợp.
Ví dụ: Điểm số GALAD (tích hợp Giới tính, Tuổi, AFP, AFP-L3 và Des-carboxy-prothrombin) minh họa cách tiếp cận này. Hệ thống sử dụng machine learning để cân nhắc và kết hợp các biến số một cách tối ưu.
Thuật toán đã nhận định danh Thiết bị Đột phá từ FDA dựa trên khả năng dự đoán HCC vượt trội so với chỉ dùng AFP đơn thuần.
Kết quả đã xác nhận năng lực của AI trong biến đổi các xét nghiệm thường quy thành công cụ phát hiện sớm mạnh mẽ thông qua tổng hợp dữ liệu thông minh.
Chẩn đoán hình ảnh và phân loại
Mô tả chính xác các tổn thương khu trú ở gan trên hình ảnh cắt lớp là thách thức chẩn đoán phức tạp với những tác động sâu rộng đến điều trị.
CT và MRI thường phát hiện các nốt trong gan xơ hóa có thể là ung thư biểu mô tế bào gan, u máu lành tính, u tuyến, ung thư đường mật trong gan hoặc bệnh di căn.
Mỗi loại đòi hỏi phương pháp quản lý hoàn toàn khác nhau.
Phân loại sai dẫn đến điều trị không phù hợp cho tổn thương lành tính hoặc can thiệp chậm trễ đối với các khối u ác tính.
Hệ thống Chẩn đoán Hỗ trợ Máy tính (CADx) sử dụng Mạng Nơ-ron Tích chập (CNN) đạt độ chính xác ấn tượng trong chẩn đoán phân biệt.
Các nghiên cứu đã công bố cho thấy độ chính xác phân loại trên 90% với nhiều loại tổn thương khác nhau.
Hệ thống đã phân tích mô hình tăng cường, đặc điểm hình thái và đặc tính kết cấu qua nhiều pha hình ảnh để đưa ra chẩn đoán theo xác suất.
Ngoài độ chính xác chẩn đoán, các hệ thống AI còn giúp giảm thiểu sinh thiết không cần thiết.
Khi tự tin xác định các thực thể lành tính, hệ thống giảm các quy trình có nguy cơ biến chứng và lo lắng cho bệnh nhân.
Đồng thời, hệ thống cũng đánh dấu các tổn thương đáng ngờ cần xác nhận mô học hoặc theo dõi chặt chẽ hơn.
Hệ thống Báo cáo và Dữ liệu Hình ảnh Gan (LI-RADS) cung cấp tiêu chuẩn chuẩn hóa cho chẩn đoán HCC.
Nó kết hợp các đặc điểm hình ảnh cụ thể như tăng tín hiệu pha động mạch (APHE), hiện tượng rửa trôi và vỏ bao tăng cường.
Tuy nhiên, áp dụng LI-RADS đòi hỏi sự chú ý tỉ mỉ đến nhiều tiêu chí và kinh nghiệm diễn giải đáng kể.
Từ đó tạo ra sự khác biệt giữa các người đọc và làm giảm hiệu quả nỗ lực chuẩn hóa.
Các công cụ tự động hóa LI-RADS hiện đại như Liver Suite của GE Healthcare trích xuất các đặc điểm chẩn đoán một cách có hệ thống và đề xuất phân loại LI-RADS với tính nhất quán vượt trội so với người đọc.
Vì vậy không chỉ cải thiện độ tin cậy chẩn đoán mà còn tăng tốc quy trình làm việc.
Khả năng này đặc biệt có giá trị tại các trung tâm khối lượng cao, nơi khối lượng công việc của bác sĩ X quang luôn vượt quá năng lực con người.
Dự đoán xâm lấn vi mạch
Xâm lấn vi mạch (MVI) là sự hiện diện của tế bào khối u trong các mạch máu nhỏ.
Đây là yếu tố dự đoán độc lập quan trọng nhất về tái phát sau cắt bỏ trong ung thư biểu mô tế bào gan.
Phát hiện mô học ảnh hưởng căn bản đến quyết định phẫu thuật, vì khối u MVI dương tính có tỷ lệ tái phát cao hơn đáng kể.
Do đó có thể đòi hỏi mép cắt tích cực hơn hoặc ưu tiên ghép gan thay vì cắt gan.
Hạn chế then chốt là MVI không thể nhìn thấy trên hình ảnh chuẩn.
Theo truyền thống, thông tin tiên lượng quan trọng chỉ có sau phẫu thuật thông qua kiểm tra bệnh lý học.
Khi đó các lựa chọn phẫu thuật đã được quyết định.
Sự ngắt quãng về thời gian giữa nhu cầu cần thông tin (trước phẫu thuật) và thu được thông tin (sau phẫu thuật) từ lâu đã cản trở lập kế hoạch phẫu thuật chính xác.
Các mô hình Deep Learning phân tích hình ảnh CT và MRI trước phẫu thuật đã đạt được bước đột phá trong dự đoán MVI không xâm lấn.
Mô hình đã công bố cho thấy giá trị diện tích dưới đường cong (AUC) vượt 0.86.
Các thuật toán này nhận diện các dấu hiệu hình ảnh tinh vi bao gồm độ không đều mép khối u, mô hình tăng cường quanh khối u và các đặc điểm radiomics không thể nhận biết bằng mắt người có tương quan với sự hiện diện MVI trong mô học.
Các bác sĩ phẫu thuật giờ đây có thể tích hợp phân tầng nguy cơ MVI vào kế hoạch trước phẫu thuật.
Họ có thể mở rộng mép cắt cho bệnh nhân nguy cơ cao hoặc ưu tiên ứng viên ghép gan thay vì cắt bỏ ở bệnh nhân trẻ với bệnh dự đoán MVI dương tính.
Đây là sự chuyển đổi căn bản từ hướng phản ứng (điều trị tái phát khi xảy ra) sang chủ động (ngăn ngừa tái phát thông qua chiến lược phẫu thuật dựa trên nguy cơ).
Dự đoán đáp ứng điều trị
Khả năng của AI trong dự đoán kết quả điều trị trước khi bắt đầu liệu pháp có lẽ là ứng dụng mang tính chuyển đổi nhất.
Do đó tạo nên y học ung thư chính xác thực sự khi ghép nối từng bệnh nhân với liệu pháp có khả năng mang lại lợi ích cao nhất.
TACE là điều trị tiêu chuẩn cho HCC giai đoạn trung bình nhưng sự không đồng nhất trong đáp ứng tạo ra tình thế lâm sàng dai dẳng.
Một số bệnh nhân đạt kiểm soát khối u đáng kể trong khi những người khác tiến triển bệnh mặc dù thực hiện nhiều lần.
Các kiến trúc Deep Learning, đặc biệt là mạng Long Short-Term Memory (LSTM) phân tích chuỗi hình ảnh theo thời gian và các mô hình CNN AlexNet cải tiến.
Vì thế có thể xác định bệnh nhân sẽ kháng TACE trước khi bắt đầu điều trị.
Ví dụ: Tại Bệnh viện, hệ thống AI có thể phân tích đặc điểm hình ảnh ban đầu, các yếu tố sinh học khối u thay thế và thông số lâm sàng để tạo xác suất đáp ứng cá nhân hóa.
Bệnh nhân được dự đoán có đáp ứng TACE kém có thể tránh các thủ thuật vô ích và biến chứng liên quan.
Thay vào đó họ được chuyển sang liệu pháp toàn thân mang lại kiểm soát bệnh tốt hơn.
Vì vậy cải thiện cả chất lượng sống và khả năng sống sót tiềm năng qua khả năng tiếp cận sớm hơn với điều trị hiệu quả.
Với sự xuất hiện của thuốc ức chế điểm kiểm tra miễn dịch (như phối hợp Atezolizumab + Bevacizumab hiện được thiết lập là liệu pháp tuyến đầu cho HCC tiến triển), dự đoán đáp ứng điều trị càng trở nên cấp bách hơn do chi phí đáng kể và hiệu quả không đồng đều của các liệu pháp này.
Hệ thống AI tích hợp dữ liệu đa phương thức kết hợp hồ sơ genomic với các đặc điểm radiomic hình ảnh đang được nghiên cứu tích cực để xác định bệnh nhân có khả năng hưởng lợi nhất từ liệu pháp miễn dịch.
Các mô hình dự đoán phân tích đặc điểm vi môi trường khối u, các thay đổi di truyền ảnh hưởng đến đáp ứng miễn dịch và các yếu tố hình ảnh thay thế cho hoạt động miễn dịch học để dự báo kết quả điều trị.
Thành công trong lĩnh vực này sẽ tạo điều kiện lựa chọn liệu pháp hợp lý.
Nó sẽ dựa trên bằng chứng thay vì phương pháp thử-sai hiện tại.
Từ đó tối đa hóa cả kết quả lâm sàng và giá trị chăm sóc sức khỏe.

Các sản phẩm được FDA và CE phê duyệt
| Tên Sản phẩm | Nhà phát triển | Loại hình Công nghệ | Chứng nhận | Chức năng và Ứng dụng Thực tế |
|---|---|---|---|---|
| AIM-NASH | PathAI (Mỹ) | AI Pathology (Giải phẫu bệnh) | FDA Cleared (2025) | Đây là công cụ AI đầu tiên được FDA phê duyệt hỗ trợ thử nghiệm lâm sàng cho bệnh gan nhiễm mỡ/viêm gan nhiễm mỡ (MASH) – tiền đề quan trọng của HCC. AI tự động chấm điểm mô học (xơ hóa, viêm, nhiễm mỡ) trên tiêu bản kỹ thuật số, giúp chuẩn hóa đánh giá và tăng tốc độ phát triển thuốc. |
| Liver AI (Oncology AI Suite) | Arterys (Mỹ) | Cloud-based AI Radiology | FDA 510(k) | Nền tảng đám mây sử dụng Deep Learning để tự động đo đạc, theo dõi tổn thương gan trên CT/MRI. Tính năng nổi bật là tự động phân đoạn gan và khối u, giúp bác sĩ theo dõi tiến triển khối u qua các lần chụp một cách chính xác. |
| Elecsys GALAD Score | Roche (Thụy Sĩ) | In-vitro Diagnostic Algorithm | FDA Breakthrough Device | Thuật toán tích hợp 3 dấu ấn sinh học (AFP, AFP-L3, PIVKA-II) cùng tuổi và giới tính để tính toán xác suất mắc HCC. Được thiết kế để cải thiện việc phát hiện sớm HCC ở bệnh nhân bệnh gan mãn tính. |
| HepatoSIGHT | Predictive Health Intelligence (Anh) | AI Casefinding | CE Mark, UKCA | Một công cụ tìm kiếm ca bệnh dựa trên dữ liệu. Nó quét hàng nghìn hồ sơ bệnh án để xác định những bệnh nhân có nguy cơ cao mắc bệnh gan tiến triển hoặc ung thư gan mà chưa được chẩn đoán, giúp can thiệp sớm. |
| DUOnco Liver | Guerbet (Pháp) | AI Radiology | CE Mark | Phần mềm chuyên biệt để phát hiện và đo đạc các tổn thương gan khu trú, hỗ trợ theo dõi đáp ứng điều trị theo tiêu chuẩn RECIST. |
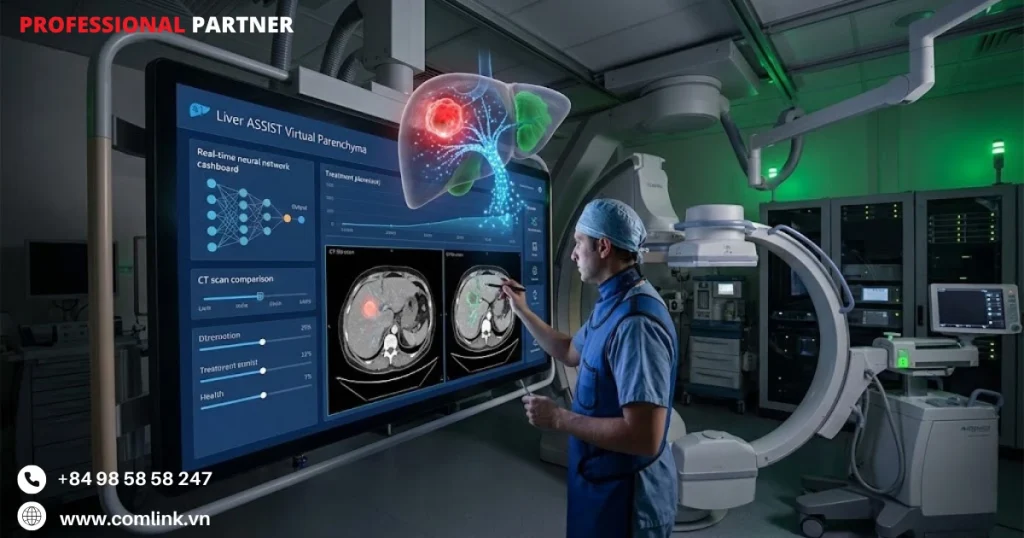
Các ứng dụng của tập đoàn y tế
GE Healthcare
Liver ASSIST Virtual Parenchyma
Liver ASSIST Virtual Parenchyma giải quyết một trong những thách thức lớn nhất trong điều trị ung thư can thiệp.
Nó đảm bảo thuốc điều trị phân bố tối ưu vào khối u gan trong khi hạn chế tối đa tổn thương lên mô gan lành.
Ứng dụng này biến đổi hình ảnh Cone-beam CT (CBCT) thông thường trong phòng chụp mạch thành một hệ thống hướng dẫn thủ thuật thông minh.
Trong các thủ thuật tắc mạch hóa trị gan (TACE) hoặc tắc mạch xạ trị gan (TARE), bác sĩ truyền thống chỉ dựa vào hình ảnh hai chiều và các mốc giải phẫu để điều khiển vị trí ống thông và ước tính phân bố thuốc.
Liver ASSIST Virtual Parenchyma thay đổi hoàn toàn cách tiếp cận khi xử lý hình ảnh CBCT 3D thu được trong quá trình thủ thuật thông qua các thuật toán học sâu tự động phân vùng nhu mô gan, cấu trúc mạch máu và khối u.
Đổi mới quan trọng nhất của hệ thống là công nghệ Virtual Parenchymography.
Đó là công nghệ mô phỏng do AI tạo ra để dự đoán chính xác vùng tưới máu được cung cấp bởi từng nhánh động mạch.
Mô hình AI phân tích cấu trúc mạch máu và mẫu dòng chảy máu để hình dung phần mô gan nào sẽ nhận được thuốc điều trị khi tiêm qua vị trí ống thông cụ thể.
Ví dụ: Tại Bệnh viện, khi điều trị bệnh nhân ung thư gan giai đoạn trung gian với khối u 5cm ở thuỳ phải, bác sĩ can thiệp có thể sử dụng Virtual Parenchymography để xác định chính xác nhánh động mạch gan phải cần đặt ống thông.
Hệ thống sẽ hiển thị màu sắc khác nhau trên màn hình 3D, cho biết vùng nào sẽ nhận được thuốc (màu đỏ) và vùng nào không bị ảnh hưởng (màu xanh).
Vì vậy giúp bác sĩ điều chỉnh vị trí ống thông trước khi tiêm thuốc hóa trị.
Khả năng này giúp bác sĩ X quang can thiệp xác nhận vị trí ống thông trước khi tiêm thuốc.
Do đó đảm bảo toàn bộ khối u nhận đủ liều điều trị trong khi giảm thiểu phơi nhiễm lên các phân đoạn gan không phải mục tiêu.
Công nghệ đã cung cấp “bản xem trước” phân bố điều trị, hỗ trợ điều chỉnh thủ thuật theo thời gian thực để tối ưu hóa hiệu quả điều trị và giảm biến chứng từ tiêm thuốc sai vị trí.
Liver Suite
Liver Suite bổ sung cho hướng dẫn thủ thuật với đánh giá chẩn đoán được chuẩn hóa.
Hệ thống Báo cáo và Dữ liệu Hình ảnh Gan (LI-RADS) cung cấp chuẩn hóa thiết yếu cho đặc điểm tổn thương gan nhưng triển khai thủ công tốn nhiều thời gian và chịu sự khác biệt giữa các bác sĩ đọc phim.
Liver Suite tự động hóa quy trình đo lường và phân loại, áp dụng các thuật toán AI nhận diện đặc điểm hình ảnh đặc trưng như:
- Tăng ngấm mạnh ở pha động mạch
- Biểu hiện thoái trào thuốc
- Ngấm thuốc của vỏ bao u
- Tốc độ phát triển vượt ngưỡng
Sau đó hệ thống phân loại các hạng mục LI-RADS phù hợp theo tiêu chí đã thiết lập.
Tự động hóa giảm đáng kể thời gian tạo báo cáo trong khi cải thiện tính nhất quán giữa các bác sĩ X quang và các bệnh viện.
Vì vâyj tạo điều kiện giao tiếp đáng tin cậy hơn giữa chuyên gia hình ảnh và bác sĩ điều trị.
Ví dụ: Khoa Chẩn đoán Hình ảnh mỗi ngày nhận hàng chục ca chụp CT/MRI gan nghi ngờ ung thư. Với Liver Suite, thời gian đọc và phân loại một ca theo LI-RADS giảm từ 15-20 phút xuống còn 3-5 phút.
Hệ thống tự động đo kích thước tổn thương, so sánh với phim cũ, gắn nhãn LI-RADS từ LR-1 (chắc chắn lành) đến LR-5 (chắc chắn HCC).
Do đó giúp bác sĩ tập trung vào đánh giá tổng thể và tư vấn điều trị.
Siemens Healthineers
AI-Rad Companion
AI-Rad Companion đại diện cho triết lý triển khai AI khác biệt cơ bản.
Nó tập trung vào phân tích toàn diện cơ quan thay vì phát hiện bệnh cụ thể.
Giải pháp xử lý các ca chụp CT bụng để tự động nhận diện, phân vùng và định lượng nhiều cơ quan bao gồm gan, lá lách, thận và các mạch máu lớn.
Đối với đánh giá ung thư gan, cách tiếp cận phân tích rộng cung cấp thông tin ngữ cảnh thiết yếu vượt ra ngoài phát hiện khối u.
Hệ thống tự động tính tổng thể tích gan, xác định gan nhiễm mỡ thông qua đo mật độ và đánh dấu tình trạng gan to bất thường hoặc teo nhỏ.
Đó là tất cả các yếu tố ảnh hưởng đến kế hoạch điều trị và tiên lượng ở bệnh nhân ung thư biểu mô tế bào gan (HCC).
Ví dụ: Tại Bệnh viện, khi một bệnh nhân 58 tuổi có tiền sử viêm gan B mạn tính đến chụp CT phát hiện khối u gan 3cm.
AI-Rad Companion không chỉ phát hiện khối u mà còn tự động:
- Tính thể tích gan: 1,850 ml (bình thường 1,400-1,800 ml) → gan to nhẹ
- Phát hiện gan nhiễm mỡ mức độ 2 (mật độ gan -5 HU)
- Đo thể tích lá lách: 420 ml (tăng gấp đôi bình thường) → gợi ý tăng áp lực tĩnh mạch cửa
- Xác định giãn tĩnh mạch cửa: đường kính 15mm
Thông tin này giúp bác sĩ nhận biết bệnh nhân có xơ gan nền.
Do đó cần cân nhắc phương án điều trị phù hợp (cắt gan có thể rủi ro cao hơn do chức năng gan giảm và tăng áp cửa).
Giá trị của AI-Rad Companion mở rộng vượt ngoài đánh giá khối u đến đánh giá bệnh gan nền.
Ung thư biểu mô tế bào gan chủ yếu phát triển ở gan xơ, khiến đánh giá tình trạng gan nền trở nên quan trọng cho lựa chọn điều trị.
Hệ thống tự động phát hiện gan nhiễm mỡ, tình trạng ảnh hưởng khoảng 25% dân số toàn cầu và là yếu tố nguy cơ đáng kể cho ung thư gan.
Do đó giúp sàng lọc có hệ thống các cá nhân có nguy cơ trước khi khối u ác tính phát triển.
Phân tích thể tích tự động cũng hỗ trợ đánh giá ghép gan và lập kế hoạch phẫu thuật thông qua cung cấp số đo chính xác các phân đoạn gan và tính thể tích gan còn lại dự kiến cho bệnh nhân cắt gan một phần.
LiverLab
LiverLab giải quyết nhu cầu quan trọng về định lượng không xâm lấn hàm lượng sắt và mỡ trong gan thông qua các quy trình MRI chuyên biệt.
Sinh thiết gan truyền thống dù được coi là tiêu chuẩn vàng nhưng vẫn có rủi ro và gặp sai số lấy mẫu.
LiverLab triển khai các chuỗi MRI tự động đo:
- PDFF (Proton Density Fat Fraction) – Phần trăm mật độ proton mỡ để định lượng gan nhiễm mỡ
- R2 mapping – Bản đồ R2* để đánh giá lắng đọng sắt
Các dấu ấn sinh học định lượng này thiết yếu cho quản lý bệnh nhân bệnh gan mạn tính, nhóm có nguy cơ cao nhất phát triển HCC.
Quy trình tự động giảm độ phức tạp kiểm tra, giảm thiểu sự khác biệt giữa người thực hiện.
Sau đó cung cấp các số đo có thể tái lập để theo dõi dọc theo thời gian nhằm giám sát tiến triển bệnh hoặc đáp ứng điều trị ở các bệnh gan chuyển hóa.
Vì vậy giúp bác sĩ theo dõi khách quan hiệu quả can thiệp lối sống mà không cần sinh thiết gan nhiều lần.
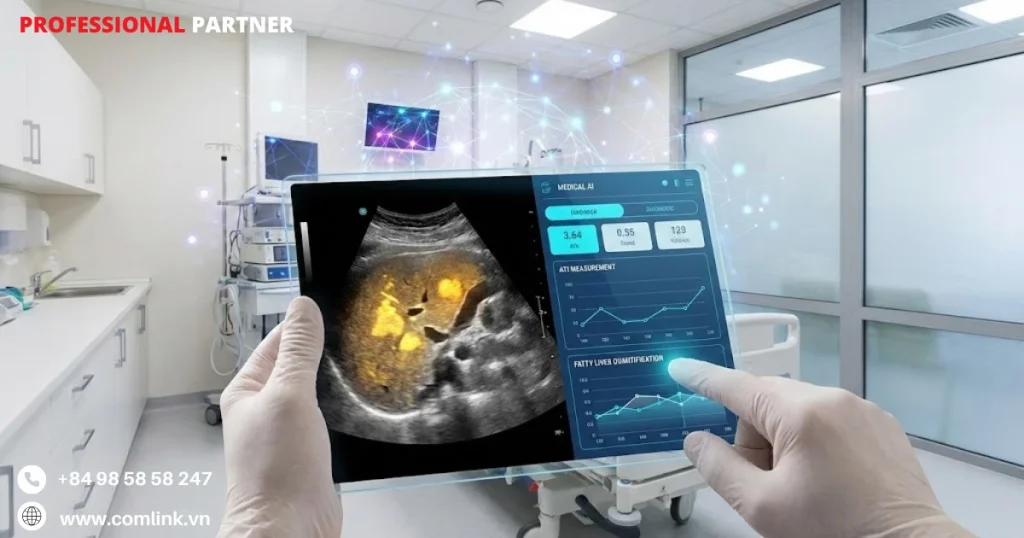
Canon Medical
Liver Analysis Package
Gói Phân Tích Gan được tích hợp vào hệ thống siêu âm cao cấp Aplio của Canon mang đặc điểm hóa mô được hỗ trợ AI đến các điểm chăm sóc.
Siêu âm vẫn là phương thức sàng lọc chính cho giám sát ung thư gan ở các nhóm nguy cơ cao do tính tiếp cận, an toàn và hiệu quả chi phí.
Tuy nhiên, siêu âm B-mode thông thường cung cấp thông tin hạn chế về thành phần mô ngoài các mẫu hình âm cơ bản.
Cải tiến AI của Canon giải quyết hạn chế này thông qua hai công nghệ bổ sung: Attenuation Imaging (ATI) và Shear Wave Elastography (SWE).
ATI – Định Lượng Gan Nhiễm Mỡ
ATI sử dụng thuật toán máy học để định lượng mức độ sóng siêu âm suy giảm khi xâm nhập vào mô gan.
Mỡ xâm nhập gây tăng suy giảm do thay đổi trở kháng âm học, tạo ra dấu ấn sinh học có thể định lượng cho gan nhiễm mỡ.
Hệ thống AI bù trừ các yếu tố gây nhiễu như độ sâu, hội tụ chùm tia và thể trạng bệnh nhân để tạo ra các hệ số suy giảm được chuẩn hóa, biểu thị bằng đơn vị dB/cm/MHz.
Phép đo khách quan biến đánh giá trực quan chủ quan về độ sáng gan thành dữ liệu định lượng có thể tái lập, tương đương với MRI-PDFF.
Do đó giúp phân độ gan nhiễm mỡ có hệ thống trong các ca khám thường quy.
Ví dụ: Tại Trung tâm Y tế, bác sĩ siêu âm sử dụng ATI để sàng lọc gan nhiễm mỡ cho bệnh nhân đái tháo đường type 2.
Thay vì chỉ mô tả “gan tăng âm, nghi nhiễm mỡ”, bác sĩ có số liệu cụ thể:
- Bệnh nhân A: ATI = 0.52 dB/cm/MHz (bình thường < 0.60)
- Bệnh nhân B: ATI = 0.78 dB/cm/MHz (gan nhiễm mỡ mức độ nhẹ)
- Bệnh nhân C: ATI = 0.95 dB/cm/MHz (gan nhiễm mỡ mức độ nặng)
Những con số này giúp theo dõi tiến triển bệnh qua thời gian và đánh giá hiệu quả điều trị một cách chính xác.
SWE – Shear Wave Elastography
Shear Wave Elastography đo độ cứng gan, một thông số thay thế đã được xác nhận cho giai đoạn xơ hóa thông qua theo dõi vận tốc lan truyền của sóng cắt được tạo ra cơ học qua mô gan.
Mô xơ hóa thể hiện độ cứng tăng lên, đo được dưới dạng vận tốc sóng cắt cao, cung cấp phân giai đoạn không xâm lấn mức độ nghiêm trọng bệnh gan.
Triển khai AI tối ưu hóa các thông số tạo sóng, tự động chọn vùng đo không có mạch máu, tạo vật và xác nhận chất lượng dữ liệu theo thời gian thực.
Tự động hóa thông minh giúp đo độ đàn hồi khả thi trong thực hành lâm sàng thường quy.
Nó cung cấp đánh giá xơ hóa tức thời hướng dẫn cường độ giám sát và mức độ cấp bách điều trị ở bệnh nhân có nguy cơ phát triển HCC.
Ví dụ Bệnh nhân viêm gan C mạn tính được theo dõi định kỳ 6 tháng/lần với SWE:
- Năm 2022: SWE = 8.5 kPa (xơ hóa F2)
- Năm 2023: SWE = 12.3 kPa (xơ hóa F3) → tăng cường siêu âm sàng lọc từ 6 tháng xuống 3 tháng/lần
- Năm 2024: SWE = 16.8 kPa (xơ hóa F4 – xơ gan) → bắt đầu sàng lọc HCC tích cực với siêu âm + AFP mỗi 3 tháng
Dự Án GRAPE
Cách tiếp cận
Dự án GRAPE (phát triển qua hợp tác giữa Bệnh viện Ung thư Chiết Giang và Viện DAMO của Alibaba) đại diện cho cách tiếp cận đầy tham vọng về phát hiện sớm ung thư chạy bằng AI trên nhiều hệ thống cơ quan.
Sáng kiến đã giải quyết thách thức cơ bản trong ung thư học khi hầu hết các bệnh ung thư, bao gồm HCC biểu hiện ở giai đoạn tiến triển khi các lựa chọn điều trị chữa khỏi bị hạn chế.
Dự án phát triển mô hình học sâu thống nhất được huấn luyện trên bộ dữ liệu chưa từng có với 100,000 ca chụp CT thu thập từ 20 cơ sở y tế.
Do đó tạo ra hệ thống có khả năng đồng thời phát hiện giai đoạn sớm:
- Ung thư biểu mô tế bào gan (HCC)
- Ung thư dạ dày
- Ung thư tuyến tụy
Kiến trúc Multi-Task Learning
Kiến trúc của mô hình sử dụng học đa nhiệm.
Khi đó một mạng thần kinh duy nhất học nhận diện các mẫu hình ảnh đặc trưng của khối u ác tính trên các vị trí giải phẫu và loại ung thư khác nhau.
Cách tiếp cận này tận dụng các đặc điểm hình ảnh chung của biến đổi ác tính sớm.
Đó là mẫu ngấm thuốc tinh vi, méo mó kiến trúc và hiệu ứng khối trong khi duy trì các con đường phát hiện đặc hiệu cơ quan.
Huấn luyện trên bộ dữ liệu khổng lồ, đa cơ sở như vậy giúp mô hình nhận ra các biểu hiện ung thư giai đoạn sớm tinh vi có thể bị bỏ sót trong diễn giải lâm sàng thường quy.
Nó đặc biệt hiệu quả các khối ung thư biểu mô tế bào gan đo dưới 2 centimet.
Kết quả kiểm định ấn tượng
Kiểm định thực tế cho thấy hiệu suất đáng chú ý khi hệ thống đạt độ nhạy 85.1% cho phát hiện khối u giai đoạn sớm trong khi duy trì độ đặc hiệu chấp nhận được để tránh báo động giả quá mức.
Hiệu suất của mô hình vượt qua các bác sĩ X quang chẩn đoán giàu kinh nghiệm trong các nghiên cứu so sánh có kiểm soát.
Do đó tích hợp AI có thể cải thiện cơ bản tỷ lệ phát hiện sớm cho các bệnh ung thư tỷ lệ tử vong cao này.
Bộ dữ liệu huấn luyện đa cơ sở tăng cường tính tổng quát hóa trên các quy trình chụp khác nhau, nhà sản xuất máy quét và nhóm dân số bệnh nhân.
Vì vậy giải quyết hạn chế phổ biến của các hệ thống AI được huấn luyện trên dữ liệu đơn trung tâm.
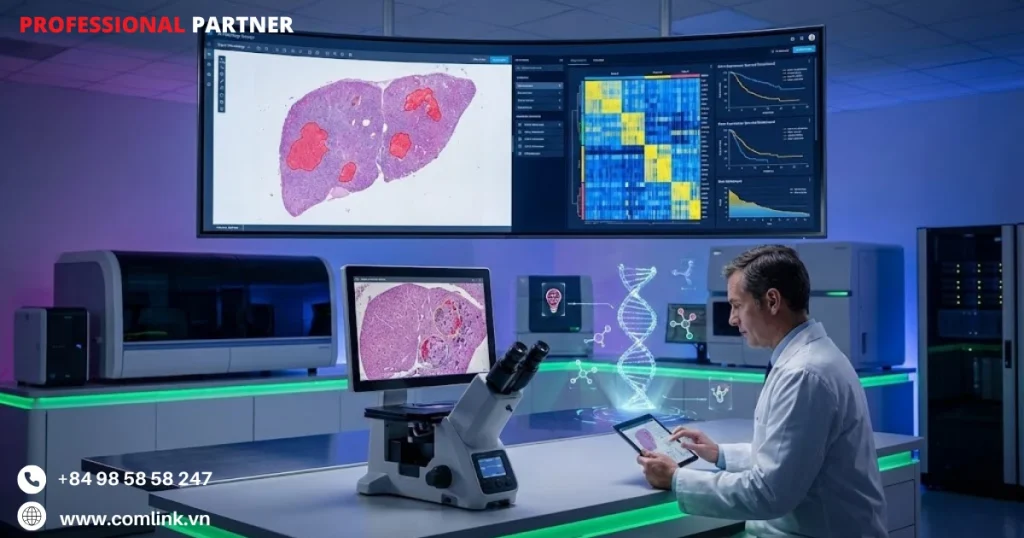
Bệnh viện Trung Sơn
Tích hợp AI vào giải phẫu và phân tích hình ảnh
Bệnh viện Trung Sơn (Trung Quốc) đã tiên phong trong tích hợp AI vào giải phẫu bệnh và phân tích hình ảnh tiên tiến.
Họ tập trung vào phân nhóm phân tử và dự đoán tiên lượng trong ung thư biểu mô tế bào gan.
Lĩnh vực ứng dụng này giải quyết nhận thức ngày càng tăng về HCC không phải là một bệnh đơn lẻ mà bao gồm nhiều nhóm phụ phân tử với các lỗ hổng điều trị khác biệt và hành vi lâm sàng.
Đánh giá mô bệnh học truyền thống cung cấp phân loại hình thái học nhưng không thể xác định các biến đổi phân tử quyết định đáp ứng điều trị với liệu pháp nhắm mục tiêu và miễn dịch trị liệu.
Nền tảng AI giải phẫu bệnh kỹ thuật số của bệnh viện phân tích hình ảnh toàn bộ tiêu bản (whole-slide images).
Nó áp dụng các thuật toán học sâu được huấn luyện để nhận ra các mẫu mô học tinh vi liên quan đến các dấu hiệu phân tử cụ thể.
Các thuật toán này có thể dự đoán các đặc điểm phân tử quan trọng bao gồm:
- Hoạt hóa beta-catenin – liên quan đến tiên lượng tốt hơn
- Đột biến TP53 – liên quan đến tiên lượng xấu, tái phát cao
- Đặc điểm vi môi trường miễn dịch – quyết định đáp ứng với miễn dịch điều trị
Tất cả trực tiếp từ các tiêu bản mô nhuộm H&E tiêu chuẩn mà không cần xét nghiệm phân tử đắt tiền.
Khả năng này giúp tiếp cận rộng hơn đến đặc điểm hóa phân tử hướng dẫn lựa chọn điều trị ung thư chính xác.
Điều này đặc biệt quan trọng trong các điều kiện tài nguyên hạn chế nơi phân tích gen toàn diện không khả dụng.
Ứng dụng Radiomics
Ứng dụng radiomics bổ sung cho AI giải phẫu bệnh thông qua trích xuất các đặc điểm hình ảnh định lượng từ các ca khám CT và MRI có tương quan với sinh học khối u và kết cục bệnh nhân.
Phân tích radiomics biến đổi hình ảnh y tế thành dữ liệu đa chiều cao thông qua tính toán hàng trăm đặc điểm mô tả:
- Hình dạng khối u: độ tròn, độ đồng đều bề mặt, tỷ lệ trục
- Kết cấu: độ không đồng nhất, entropy, năng lượng
- Phân bố cường độ: trung bình, độ lệch chuẩn, độ xiên, độ nhọn
- Động học ngấm thuốc: tốc độ tăng, độ rửa trôi, AUC
Các mô hình máy học được huấn luyện trên các đặc điểm này có thể dự đoán:
- Độ mô học khối u (G1-G3): khối u càng kém biệt hóa càng ác tính
- Nguy cơ xâm lấn vi mạch (MVI): yếu tố tiên lượng quan trọng sau phẫu thuật
- Khả năng tái phát sau cắt bỏ phẫu thuật
Đặc điểm hóa phân tử không xâm lấn này giúp lập kế hoạch điều trị cá nhân hóa.
Nó xác định bệnh nhân cần điều trị tích cực so với những người phù hợp với quản lý bảo tồn, trước can thiệp phẫu thuật, tối ưu hóa phân bổ tài nguyên và cải thiện kết cục thông qua phân tầng nguy cơ chính xác.
Quy trình thực tế
Trường hợp 1 – Nguy cơ thấp:
- Bệnh nhân 52 tuổi, HCC 3.5cm, AFP 45 ng/ml
- Radiomics: độ đồng nhất cao, ít vùng hoại tử, ngấm thuốc đồng đều
- Dự đoán: Độ mô học G1, không có MVI, nguy cơ tái phát thấp
- Quyết định: Cắt gan đơn thuần, không cần hóa trị bổ trợ
Trường hợp 2 – Nguy cơ cao:
- Bệnh nhân 61 tuổi, HCC 4.2cm, AFP 850 ng/ml
- Radiomics: không đồng nhất cao, nhiều vùng hoại tử, viền không rõ
- Dự đoán: Độ mô học G3, có MVI, nguy cơ tái phát cao
- Quyết định: Cắt gan + hóa trị bổ trợ + theo dõi chặt chẽ hậu phẫu
Cách tiếp cận này đặc biệt phù hợp với Việt Nam, nơi tài nguyên y tế còn hạn chế và kết quả phân loại rõ ràng giữa bệnh nhân nguy cơ cao/thấp.
Do đó giúp sử dụng hiệu quả các liệu pháp đắt tiền như thuốc nhắm mục tiêu (Sorafenib, Lenvatinib) hoặc miễn dịch điều trị (Nivolumab, Pembrolizumab).
Có thể bạn quan tâm

Liên hệ

Địa chỉ
Tầng 3 Toà nhà VNCC
243A Đê La Thành Str
Q. Đống Đa-TP. Hà Nội

info@comlink.com.vn

Phone
+84 98 58 58 247











