

Ứng dụng AI cho ung thư phổi là gì
Ứng dụng AI cho ung thư phổi là dùng công nghệ và thuật toán AI hỗ trợ điều trị ung thư phổi từ phát hiện, chẩn đoán và ra quyết định đến dự đoán tiên lượng.
Ứng dụng AI cho ung thư phổi giúp giảm khối lượng công việc đọc tiêu bản LDCT, CXR và bệnh lý và tăng độ chính xác trong việc phát hiện nốt.
Khi đưa AI vào WSI trong bệnh lý kỹ thuật số làm tăng giá trị Kappa của bác sĩ bệnh học và giúp dự đoán kiểu hình phân tử bằng kỹ thuật xạ hình và nhuộm H&E.
Bằng cách trích xuất kỹ thuật xạ hình từ dữ liệu hình ảnh và WSI từ lĩnh vực mô bệnh học, các bác sĩ lâm sàng có thể sử dụng AI để dự đoán các đặc tính của khối u như đột biến gen và biểu hiện PD-L1.
Hơn nữa, AI có thể hỗ trợ các bác sĩ lâm sàng để ra quyết định bằng cách dự đoán đáp ứng điều trị, tác dụng phụ và dự đoán tiên lượng trong điều trị y tế, phẫu thuật và xạ trị.
Trong tương lai, xu hướng phát triển sẽ hướng tới các mô hình đa phương thức (multimodal models), có khả năng kết hợp và phân tích đồng thời dữ liệu từ nhiều nguồn khác nhau như hình ảnh, hồ sơ lâm sàng, dữ liệu di truyền và dữ liệu bệnh án điện tử để đưa ra những dự đoán và quyết định chính xác hơn.

Nghiên cứu hệ gen ung thư phổi
Đột biến và biến thể gen
Xác định và phân tích đột biến cùng biến thể gen là một trong những ứng dụng cốt lõi nhất của AI trong nghiên cứu hệ gen ung thư phổi.
Các phương pháp giải trình tự truyền thống tuy chính xác, nhưng thường gặp khó khăn khi xử lý khối lượng và độ phức tạp khổng lồ của dữ liệu di truyền từ các công nghệ giải trình tự thông lượng cao hiện đại.
Thuật toán AI vượt trội trong môi trường này khi tận dụng các mô hình học máy để nhận diện những mẫu đột biến tinh vi mà các phương pháp phân tích thông thường có thể bỏ qua.
Thuật toán học máy có thể xử lý hàng nghìn chuỗi gen đồng thời.
Do đó không chỉ nhận diện những đột biến gây ung thư đã biết mà còn tìm ra những biến thể mới có thể góp phần vào sự phát triển của ung thư phổi.
Các hệ thống này phân biệt được đột biến điều khiển (những đột biến trực tiếp góp phần vào tiến triển ung thư) và đột biến thụ động xảy ra như sản phẩm phụ của sự bất ổn tế bào.
Điều này rất quan trọng để phát triển liệu pháp nhắm mục tiêu vì đột biến điều khiển thường đại diện cho những mục tiêu có thể tác động trong các cách tiếp cận y học cá thể hóa.
Ví dụ: Hệ thống AI có thể phân tích đồng thời dữ liệu gen từ 10.000 bệnh nhân ung thư phổi và phát hiện ra rằng những bệnh nhân có đột biến EGFR đặc biệt sẽ đáp ứng tốt với thuốc erlotinib, trong khi những người có đột biến KRAS lại cần phác đồ điều trị khác hoàn toàn.
Ý nghĩa lâm sàng của phân tích đột biến được AI hỗ trợ vượt xa kết quả phát hiện đơn thuần.
Thông qua phân tích các mẫu đột biến trên các nhóm bệnh nhân lớn, hệ thống AI có thể dự đoán phản ứng điều trị, xác định cơ chế kháng thuốc trước khi chúng trở nên rõ ràng về mặt lâm sàng.
Từ đó đề xuất các chiến lược điều trị cá nhân hóa.
Khả năng này biến đổi thông tin di truyền từ công cụ chẩn đoán tĩnh thành hướng dẫn động lực cho tối ưu hóa điều trị.
Vì vậy dẫn đến cải thiện tỷ lệ sống sót và giảm độc tính liên quan đến điều trị.
Bất ổn định của hệ gen
Bất ổn hệ gen đại diện cho một đặc điểm nổi bật của sinh học ung thư.
Chúng được đặc trưng bởi xu hướng gia tăng các biến đổi di truyền thúc đẩy tiến triển khối u và kháng điều trị.
Các ứng dụng AI trong đánh giá bất ổn hệ gen vượt xa phân tích tế bào di truyền truyền thống.
AI sử dụng các thuật toán tinh vi để phát hiện biến thể cấu trúc phức tạp, sắp xếp lại nhiễm sắc thể và các mẫu mất cân bằng nhiễm sắc thể góp phần vào phát triển và tiến triển ung thư phổi.
Các mô hình tính toán tiên tiến có thể phân tích dữ liệu giải trình tự toàn bộ hệ gen để xác định dấu hiệu của bất ổn hệ gen bao gồm thiếu hụt tái tổ hợp tương đồng, bất ổn vi vệ tinh và các sự kiện bệnh sán lá gan.
Những hệ thống AI này có thể định lượng mức độ bất ổn và dự đoán cách sự hỗn loạn hệ gen có thể ảnh hưởng đến phản ứng điều trị, đặc biệt đối với các tác nhân gây tổn thương DNA và cách tiếp cận miễn dịch trị liệu.
Khả năng đánh giá bất ổn hệ gen một cách toàn diện cung cấp cho các bác sĩ lâm sàng thông tin tiên lượng có giá trị và giúp định hướng lựa chọn điều trị.
Ví dụ: Trong nghiên cứu gần đây tại Trung tâm Ung thư MD Anderson, hệ thống AI đã phân tích 5.000 mẫu ung thư phổi và phát hiện những khối u có chỉ số bất ổn hệ gen cao hơn 0.8 thường đáp ứng tốt hơn 60% với liệu pháp miễn dịch chất ức chế điểm kiểm tra so với những khối u có chỉ số thấp hơn.
Hơn nữa, phân tích các mẫu bất ổn hệ gen được AI điều khiển có thể xác định các lỗ hổng điều trị trong tế bào ung thư.
Các khối u có mức độ bất ổn hệ gen cao có thể dễ bị tổn thương hơn với một số liệu pháp nhắm mục tiêu hoặc thuốc ức chế điểm kiểm soát miễn dịch.
Thông tin này giúp các bác sĩ lâm sàng khai thác những điểm yếu di truyền của chính ung thư, biến sự bất ổn của khối u từ thách thức thành cơ hội điều trị.

Biểu sinh học
Các biến đổi biểu sinh bao gồm các mẫu methyl hóa DNA, biến đổi histone và điều hòa RNA không mã hóa, đóng vai trò quan trọng trong phát triển và tiến triển ung thư phổi.
Các ứng dụng AI trong biểu sinh học tận dụng thuật toán học máy để phân tích các cảnh quan methyl hóa phức tạp, dự đoán các mẫu biểu hiện gen và xác định các dấu ấn sinh học biểu sinh có thể hướng dẫn quyết định điều trị.
Các mô hình học máy vượt trội trong tích hợp nhiều lớp thông tin biểu sinh, bao gồm dữ liệu methyl hóa, hồ sơ khả năng tiếp cận chromatin, và chữ ký phiên mã, để tạo ra bức tranh toàn diện về các mạng điều hòa gen trong ung thư phổi.
Những hệ thống này có thể xác định các phân nhóm biểu sinh của ung thư phổi có thể đáp ứng khác nhau với các can thiệp điều trị khác nhau bao gồm liệu pháp nhắm mục tiêu và miễn dịch trị liệu.
Khả năng đặc trưng hóa cảnh quan biểu sinh cung cấp thêm chiều hướng cho các cách tiếp cận y học chính xác vượt ra ngoài phân tích di truyền truyền thống.
Ví dụ: Công ty Illumina đã phát triển một hệ thống AI có thể phân tích 450.000 điểm methyl hóa trong một mẫu ung thư phổi và dự đoán với độ chính xác 85% liệu bệnh nhân có đáp ứng với thuốc ức chế DNA methyltransferase như 5-azacytidine hay không.
Ý nghĩa điều trị của phân tích biểu sinh được AI điều khiển đặc biệt hứa hẹn vì các biến đổi biểu sinh có khả năng đảo ngược thông qua can thiệp dược lý.
Hệ thống AI có thể dự đoán bệnh nhân nào có thể hưởng lợi từ các liệu pháp biểu sinh như thuốc ức chế DNA methyltransferase hoặc thuốc ức chế histone deacetylase, dù là liệu pháp đơn độc hay kết hợp với các phương thức điều trị khác.
Khả năng này mở ra những con đường mới cho các chiến lược điều trị cá nhân hóa nhắm mục tiêu không chỉ các biến đổi di truyền mà còn cả rối loạn biểu sinh.
Sinh thiết lỏng không xâm lấn
Phát triển các kỹ thuật sinh thiết lỏng không xâm lấn đại diện cho một trong những ứng dụng hứa hẹn nhất của AI trong nghiên cứu hệ gen ung thư phổi.
Những phương pháp này phân tích DNA khối u tuần hoàn (ctDNA), tế bào ung thư tuần hoàn (CTCs) và các dấu ấn sinh học khác có trong mẫu máu để phát hiện và theo dõi ung thư phổi mà không cần các quy trình lấy mẫu mô xâm lấn.
Thuật toán AI đặc biệt phù hợp cho phân tích sinh thiết lỏng vì chúng có thể phát hiện nồng độ cực thấp của vật liệu di truyền nguồn gốc khối u trong nền DNA bình thường khổng lồ có trong tuần hoàn.
Các mô hình học máy có thể xác định các mẫu đột biến, chữ ký methyl hóa và các biến đổi hệ gen khác từ lượng vật liệu di truyền tuần hoàn tối thiểu.
Do đó tạo điều kiện phát hiện sớm ung thư phổi khi các lựa chọn điều trị hiệu quả nhất.
Ví dụ: Công ty Guardant Health đã phát triển test Guardant360 sử dụng AI để phân tích ctDNA từ chỉ 10ml máu và có thể phát hiện ung thư phổi giai đoạn I với độ nhạy 85%, so với 65% của phương pháp chụp CT thông thường.
Các ứng dụng lâm sàng của sinh thiết lỏng được AI tăng cường vượt xa chẩn đoán ban đầu để bao gồm theo dõi điều trị, phát hiện kháng thuốc, và giám sát tái phát bệnh.
Những hệ thống này có thể theo dõi các thay đổi trong dấu ấn sinh học tuần hoàn theo thời gian.
Từ đó cung cấp thông tin chi tiết thời gian thực về hiệu quả điều trị và tiến hóa khối u.
Khả năng này giúp các bác sĩ lâm sàng điều chỉnh các chiến lược điều trị một cách linh hoạt.
Vì thế có khả năng ngăn chặn điều trị thất bại và cải thiện kết quả dài hạn cho bệnh nhân ung thư phổi.
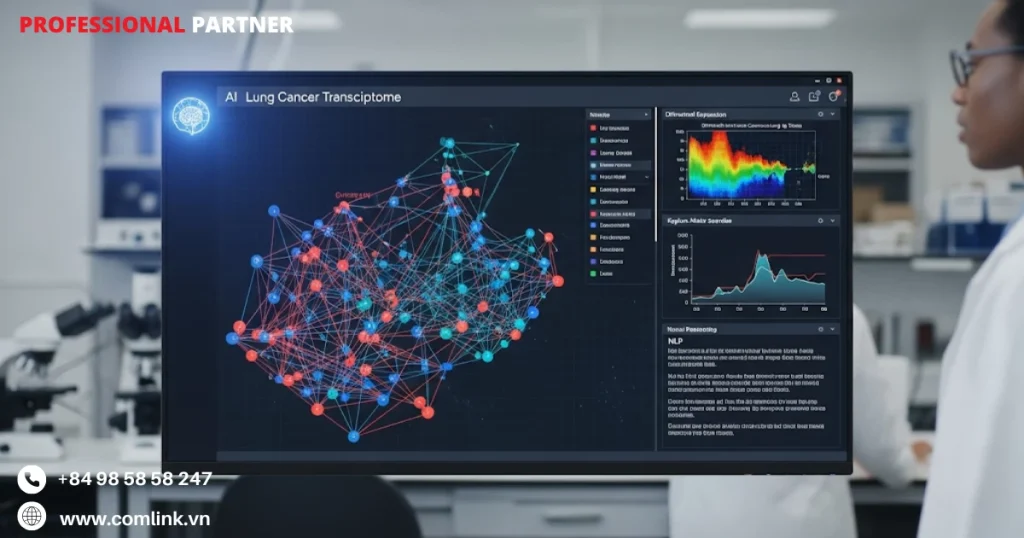
Nghiên cứu hệ gen phiên mã ung thư phổi
Phân tích biểu hiện gen
Phân tích hồ sơ biểu hiện gen đóng vai trò như nền tảng cốt lõi của nghiên cứu phiên mã học.
Phương pháp này thể hiện phép đo định lượng mức độ phiên mã RNA trên hàng nghìn gen cùng một lúc.
Trong nghiên cứu ung thư phổi, phương pháp này truyền thống dựa vào công nghệ microarray và gần đây hơn là các nền tảng giải trình tự RNA (RNA-Seq) để nắm bắt các dấu hiệu phân tử phức tạp phân biệt mô ác tính với mô bình thường.
Tích hợp AI vào phân tích hồ sơ biểu hiện gen đã biến đổi căn bản bối cảnh phân tích, giúp các nhà nghiên cứu có thể xử lý và giải thích các tập dữ liệu khổng lồ với độ chính xác và tốc độ chưa từng có.
Các thuật toán học máy, đặc biệt là mạng nơ-ron học sâu, vượt trội trong nhận diện các mô hình tinh tế trong dữ liệu biểu hiện gen đa chiều mà các phương pháp thống kê thông thường hầu như không thể phát hiện.
Các hệ thống AI này có thể đồng thời phân tích mức biểu hiện của hàng chục nghìn gen trên nhiều mẫu bệnh nhân.
Do đó xác định các phân nhóm phân tử của ung thư phổi tương quan với các kết quả lâm sàng, phản ứng điều trị và chỉ số tiên lượng riêng biệt.
Hơn nữa, phân tích biểu hiện gen dựa trên AI đã chứng minh giá trị đặc biệt trong phát triển các bảng dấu ấn sinh học dự đoán cho chẩn đoán ung thư phổi và lựa chọn điều trị.
Các thuật toán tiên tiến có thể tích hợp dữ liệu biểu hiện từ nhiều gen để tạo ra các chữ ký tổng hợp thể hiện sức mạnh dự đoán vượt trội so với các dấu ấn sinh học đơn gen.
Phương pháp tính toán này đã dẫn đến xác định các mục tiêu điều trị mới và phát triển các chiến lược điều trị cá nhân hóa tính đến hồ sơ phân tử độc đáo của từng khối u bệnh nhân.
Ví dụ: Nền tảng OncotypeDX Lung sử dụng AI để phân tích 14 gen và tạo ra điểm số dự đoán nguy cơ tái phát ung thư phổi giai đoạn sớm, giúp bác sĩ quyết định có nên tiến hành hóa trị bổ trợ hay không.
Nghiên cứu RNA không mã hóa
Phân tích RNA không mã hóa (ncRNA) đại diện cho một lĩnh vực mở rộng nhanh chóng trong nghiên cứu ung thư phổi.
Phân tích RNA bao gồm:
- MicroRNA (miRNA).
- RNA không mã hóa dài (lncRNA).
- RNA vòng (circRNA).
- Các loại RNA điều hòa khác không mã hóa protein nhưng đóng vai trò quan trọng trong điều hòa gen và chức năng tế bào.
Các thực thể phân tử này đã nổi lên như những yếu tố then chốt trong cơ chế bệnh sinh ung thư phổi do ảnh hưởng đến các quá trình như khởi đầu khối u, tiến triển, di căn và kháng thuốc.
Các ứng dụng AI trong phân tích ncRNA đã chứng minh tính chất đột phá đặc biệt do sự phức tạp vốn có của mạng RNA điều hòa và các chức năng phụ thuộc bối cảnh.
Thuật toán học máy vượt trội trong dự đoán tương tác miRNA-mục tiêu.
Chúng xác định các phức hợp lncRNA-protein có liên quan chức năng và lập bản đồ các mạch điều hòa phức tạp chi phối hành vi tế bào ung thư phổi.
Các mô hình học sâu, được huấn luyện trên tập dữ liệu lớn về tương tác ncRNA đã được xác thực thực nghiệm.
Vì thế có thể dự đoán các mối quan hệ điều hòa mới với độ chính xác đáng kinh ngạc, tăng tốc tiến độ khám phá trong lĩnh vực này.
Ý nghĩa lâm sàng của nghiên cứu ncRNA dựa trên AI rất lớn khi các phân tử điều hòa này thường đóng vai trò dấu ấn sinh học sớm của tiến triển bệnh và phản ứng điều trị.
Các hệ thống AI có thể tích hợp hồ sơ biểu hiện ncRNA với dữ liệu lâm sàng để phát triển các mô hình tiên lượng tinh vi vượt trội hơn các hệ thống phân giai đoạn lâm sàng truyền thống.
Ngoài ra, xác định các mạng ncRNA rối loạn đã mở ra con đường mới cho can thiệp điều trị với AI hỗ trợ ưu tiên các mục tiêu hứa hẹn nhất cho nỗ lực phát triển thuốc.
Ví dụ: Công ty miRagen Therapeutics sử dụng AI để phát triển thuốc điều trị dựa trên microRNA-155, một loại miRNA quan trọng trong việc điều hòa phản ứng miễn dịch chống ung thư phổi.

Giải mã các biến đổi mRNA
Ứng dụng AI trong phân tích biến đổi mRNA đã nổi lên như một lĩnh vực tiên tiến trong nghiên cứu ung thư phổi.
AI tập trung vào phát hiện và đặc tính hóa chức năng của các biến đổi hóa học lên phân tử RNA thông tin.
Các biến đổi này gọi chung là hệ biểu gen phiên mã, bao gồm N6-methyladenosine (m6A), pseudouridine và nhiều thay đổi hóa học khác ảnh hưởng đến tính ổn định mRNA, hiệu quả dịch mã và vị trí tế bào.
Các thách thức kỹ thuật liên quan đến phát hiện và định lượng biến đổi mRNA đã khiến lĩnh vực này đặc biệt phù hợp với các giải pháp dựa trên AI.
Thuật toán học máy tiên tiến có thể xử lý dữ liệu giải trình tự phức tạp từ các giao thức đặc hiệu biến đổi, như MeRIP-seq hoặc giải trình tự RNA trực tiếp, để xác định các vị trí biến đổi với độ chính xác và độ nhạy cao.
Các hệ thống AI này có thể phân biệt tín hiệu biến đổi thật với các tạo phẩm kỹ thuật.
Đó là một khả năng quan trọng do tính chất tinh tế của nhiều dấu hiệu biểu gen phiên mã.
Hơn nữa, AI đã chứng minh hiệu quả trong dự đoán hệ quả chức năng của biến đổi mRNA trong ung thư phổi.
Qua tích hợp bản đồ biến đổi với dữ liệu biểu hiện gen, đo lường độ dồi dào protein và kết quả lâm sàng, các mô hình học máy có thể xác định các mô hình biến đổi tương quan với các kiểu hình ung thư cụ thể.
Phương pháp này đã tiết lộ cách các biến đổi mRNA rối loạn góp phần vào tiến triển ung thư phổi và đã xác định các mục tiêu điều trị tiềm năng trong bộ máy biểu gen phiên mã.
Ví dụ: Các nhà nghiên cứu tại Đại học Stanford đang sử dụng AI để phân tích m6A modifications trong tế bào ung thư phổi, phát hiện ra protein FTO (một enzyme xóa m6A) có thể là mục tiêu điều trị mới.
Phân tích đơn tế bào và tính dị thể hóa tế bào
Các ứng dụng AI trong phiên mã học đơn tế bào có lẽ đại diện cho lĩnh vực đòi hỏi tính toán chuyên sâu nhất trong nghiên cứu ung thư phổi.
Chúng yêu cầu các thuật toán tinh vi để xử lý và giải thích dữ liệu từ hàng nghìn thậm chí hàng triệu tế bào riêng lẻ.
Các công nghệ giải trình tự RNA đơn tế bào (scRNA-seq) đã thay đổi hiểu biết về tính dị thể khối u thông qua việc tiết lộ các quần thể tế bào đa dạng cấu thành mô ung thư phổi.
Đó là tế bào ác tính, xâm nhập miễn dịch, thành phần mô đệm và các yếu tố vi môi trường khác nhau.
Các thách thức phân tích do dữ liệu đơn tế bào đặt ra bao gồm tính đa chiều cao, nhiễu kỹ thuật và sự thưa thớt tế bào đã khiến AI trở thành công cụ không thể thiếu cho giải thích sinh học có ý nghĩa.
Các thuật toán học máy vượt trội trong phân cụm tế bào, phân tích quỹ đạo và xác định các quần thể tế bào hiếm có thể đóng vai trò quan trọng trong tiến triển ung thư hoặc kháng điều trị.
Các phương pháp học sâu, đặc biệt là bộ mã hóa tự biến phân và mạng nơ-ron đồ thị đã chứng minh đặc biệt hiệu quả trong nắm bắt các mối quan hệ phức tạp giữa các tế bào và xác định các con đường phát triển hoặc biệt hóa.
Ứng dụng lâm sàng của phân tích đơn tế bào dựa trên AI đang nhanh chóng xuất hiện.
Với các nhà nghiên cứu sử dụng các phương pháp này để xác định dấu ấn sinh học tế bào của phản ứng điều trị, lập bản đồ sự tiến hóa của kháng thuốc, và đặc tính hóa vi môi trường miễn dịch với mức độ chi tiết chưa từng có.
Những thông tin này đang trực tiếp thúc đẩy việc phát triển liệu pháp miễn dịch kết hợp và các chiến lược điều trị cá nhân hóa tính đến độ phức tạp tế bào của từng khối u.
Ví dụ: 10x Genomics kết hợp với các trung tâm ung thư hàng đầu sử dụng AI để phân tích hàng triệu tế bào ung thư phổi, tạo ra “bản đồ tế bào” giúp dự đoán khả năng đáp ứng với thuốc ức chế điểm kiểm soát miễn dịch.
Động lực không thời gian
Các ứng dụng AI trong phiên mã học không-thời gian đại diện cho tiên phong của nghiên cứu ung thư phổi.
AI tích hợp thông tin không gian về các mô hình biểu hiện gen với động lực thời gian của sự tiến hóa khối u.
Lĩnh vực mới này kết hợp các công nghệ hình ảnh tiên tiến với phân tích hồ sơ phân tử để tạo ra bản đồ toàn diện về cách biểu hiện gen thay đổi qua kiến trúc mô và phát triển theo thời gian trong quá trình tiến triển ung thư.
Các công nghệ phiên mã học không gian, như Visium, MERFISH và seqFISH, tạo ra các tập dữ liệu phức tạp yêu cầu thuật toán AI tinh vi để giải thích có ý nghĩa.
Các mô hình học máy có thể xác định gradient biểu hiện không gian, phát hiện mạng truyền thông tế bào và lập bản đồ tổ chức ba chiều của mô khối u với độ chính xác đáng kinh ngạc.
Các phương pháp này đã tiết lộ cách tổ chức không gian ảnh hưởng đến hành vi tế bào ung thư và cách kiến trúc khối u phát triển đáp ứng với can thiệp điều trị.
Chiều thời gian thêm một lớp phức tạp nữa khi yêu cầu các hệ thống AI có khả năng theo dõi các thay đổi phiên mã theo thời gian và dự đoán trạng thái tế bào tương lai.
Các phương pháp mô hình hóa động thường dựa trên neural ODE hoặc mạng nơ-ron hồi quy, có thể nắm bắt động học của thay đổi biểu hiện gen và xác định các điểm chuyển đổi quan trọng trong tiến triển ung thư.
Những thông tin về thời gian này đang chứng minh vô cùng có giá trị trong hiểu cơ chế kháng thuốc và tối ưu hóa chiến lược thời điểm điều trị.
Ví dụ: Viện Ung thư Memorial Sloan Kettering đang phát triển nền tảng AI có tên “TumorTracker” để theo dõi sự thay đổi không gian-thời gian của tế bào ung thư phổi, giúp dự đoán vùng nào của khối u sẽ kháng thuốc trước khi điều trị.
Tái tạo mạng điều hòa
Các ứng dụng AI trong phân tích mạng điều hòa yếu tố phiên mã đại diện cho phương pháp cấp độ hệ thống để hiểu sinh học ung thư phổi.
Chúng tập trung vào mạng lưới phức tạp các tương tác điều hòa kiểm soát chương trình biểu hiện gen.
Các yếu tố phiên mã hoạt động như những bộ điều hòa chủ của bản sắc và chức năng tế bào.
Vì vậy điều phối biểu hiện của hàng trăm hoặc hàng nghìn gen mục tiêu phía hạ lưu thông qua các mạch điều hòa phức tạp.
Tái tạo mạng điều hòa từ dữ liệu phiên mã đặt ra những thách thức tính toán đáng kể.
Khi đó yêu cầu thuật toán có khả năng suy ra mối quan hệ nhân quả từ dữ liệu tương quan trong khi tính đến các yếu tố nhiễu và hiệu ứng gián tiếp.
Các phương pháp AI, đặc biệt những phương pháp dựa trên suy luận nhân quả và mô hình đồ thị đã cho thấy thành công đáng kinh ngạc khi xác định các mối quan hệ điều hòa thực sự và phân biệt chúng với các tương quan giả mạo.
Những phân tích dựa trên mạng này đã tiết lộ các nguyên lý cơ bản của điều hòa ung thư phổi.
Đó là xác định các động lực phiên mã chính, đặc tính hóa các mô-đun điều hòa, và lập bản đồ các thứ bậc phát triển.
Từ góc độ điều trị, phân tích mạng dựa trên AI đã xác định các mục tiêu thuốc tiềm năng, dự đoán chiến lược liệu pháp kết hợp và tiết lộ dấu ấn sinh học của phản ứng điều trị dựa trên trạng thái mạng điều hòa.
Ví dụ: Nhóm nghiên cứu tại Viện Công nghệ Massachusetts (MIT) đã phát triển thuật toán AI có tên “RegNetAnalyzer” có thể xác định được 15 yếu tố phiên mã chính điều khiển sự chuyển đổi từ tế bào phổi bình thường sang ác tính, mở ra khả năng can thiệp sớm trong quá trình ung thư hóa.
Phân tích miễn dịch học ung thư phổi
Phân tích các cơ chế trốn tránh miễn dịch
Tế bào ung thư sở hữu khả năng đặc biệt để trốn tránh sự giám sát của hệ miễn dịch.
Vì thế về cơ bản chúng trở nên “vô hình” trước hệ thống phòng vệ tự nhiên của cơ thể.
Khả năng này đại diện cho một trong những thách thức quan trọng nhất trong điều trị ung thư vì nó giúp các tế bào ác tính phát triển không kiểm soát được dù có sự hiện diện của hệ miễn dịch hoạt động bình thường.
Sự phức tạp của các cơ chế trốn tránh này từ lâu đã làm các nhà nghiên cứu bối rối, nhưng AI hiện đang cung cấp những khả năng chưa từng có về các chiến lược sinh tồn tinh vi này.
Thuật toán AI vượt trội trong nhận diện các mô hình trong bộ dữ liệu khổng lồ mà các con người không thể phát hiện thủ công.
Trong bối cảnh trốn tránh miễn dịch của ung thư phổi, các mô hình học máy có thể đồng thời phân tích nhiều lớp dữ liệu sinh học.
Nội dung phân tích bao gồm:
- Hồ sơ biểu hiện gen.
- Tương tác protein.
- Con đường chuyển hóa và mạng lưới giao tiếp tế bào.
Từ đó lập bản đồ các cơ chế chính xác mà tế bào ung thư sử dụng nhằm tránh sự phát hiện của miễn dịch.
Những phân tích được hỗ trợ bởi AI này tiết lộ cách các tế bào ung thư thao túng các điểm kiểm soát miễn dịch, thay đổi quá trình trình diện kháng nguyên, và tạo ra môi trường ức chế miễn dịch có hiệu quả vô hiệu hóa phản ứng miễn dịch.
Ví dụ: Hệ thống AI DeepTumor đã phân tích hơn 10.000 mẫu ung thư phổi và phát hiện ra rằng các tế bào ung thư thường sản xuất protein PD-L1 quá mức để “che giấu” mình khỏi tế bào T, giống như đeo mặt nạ để tránh bị nhận ra.
Ý nghĩa thực tiễn của phân tích trốn tránh miễn dịch dựa trên AI rất sâu sắc đối với phát triển liệu pháp.
Khi hiểu chính xác cách các tế bào ung thư phổi thoát khỏi sự giám sát miễn dịch, các nhà nghiên cứu có thể phát triển các can thiệp có mục tiêu nhằm khôi phục chức năng hệ miễn dịch.
Kiến thức này tạo điều kiện cho thiết kế hợp lý các liệu pháp kết hợp đồng thời tấn công ung thư và đảo ngược tình trạng ức chế miễn dịch.
Do đó đạt được các giao thức điều trị hiệu quả hơn và cải thiện kết quả cho bệnh nhân.
Lập bản đồ chính xác các đột biến gen
Khả năng di truyền của ung thư phổi có tính đa dạng đáng kể.
Mỗi khối u chứa một chòm sao độc đáo các đột biến trực tiếp ảnh hưởng đến tương tác hệ miễn dịch.
Các đột biến gen liên quan đến miễn dịch đóng vai trò quan trọng để xác định mức độ hiệu quả mà hệ miễn dịch có thể nhận ra và loại bỏ các tế bào ung thư.
Vì thế khiến xác định và mô tả đặc điểm của chúng trở nên cần thiết cho các phương pháp điều trị cá nhân hóa.
Các phương pháp phân tích di truyền truyền thống tuy có giá trị, thường gặp khó khăn trong việc nắm bắt toàn bộ sự phức tạp của các mô hình đột biến này và hậu quả chức năng của chúng.
Công nghệ AI biến đổi phân tích đột biến gen thông qua việc sử dụng các thuật toán tinh vi có thể xử lý dữ liệu giải trình tự toàn bộ gen và toàn bộ exome với tốc độ và độ chính xác chưa từng có.
Các mô hình học máy có thể xác định không chỉ các đột biến riêng lẻ mà còn các chữ ký đột biến và mô hình phức tạp cùng nhau ảnh hưởng đến chức năng miễn dịch.
Những hệ thống AI này có thể dự đoán tác động chức năng của các đột biến cụ thể lên các con đường liên quan đến miễn dịch.
Từ đó đánh giá khả năng nhận ra của hệ miễn dịch, và xác định tiềm năng cho việc nhắm mục tiêu điều trị.
Ví dụ: Hệ thống ImmuneMutation AI đã phát hiện ra một nhóm 47 đột biến mới trong gen BRCA2 ở bệnh nhân ung thư phổi, những đột biến này làm tăng 3 lần khả năng đáp ứng với liệu pháp miễn dịch so với nhóm đột biến truyền thống.
Hơn nữa, phân tích di truyền dựa trên AI tạo điều kiện xác định các đột biến liên quan đến miễn dịch chưa được biết đến trước đây và ý nghĩa lâm sàng của chúng.
Thông qua tích hợp dữ liệu đột biến với kết quả lâm sàng và phản ứng điều trị, các mô hình AI có thể thiết lập mối quan hệ dự đoán hướng dẫn lựa chọn điều trị.
Cách tiếp cận này biến đổi phân tích đột biến gen từ một bài tập mô tả thành một công cụ dự đoán mạnh mẽ trực tiếp thông báo cho việc ra quyết định điều trị.
Kết quả thu được sẽ tạo ra các chiến lược điều trị cá nhân hóa chính xác và hiệu quả hơn cho bệnh nhân ung thư phổi.
Phân tích đột biến khối u (TMB) toàn diện
Gánh nặng Đột biến Khối u (TMB) đã nổi lên như một dấu ấn sinh học quan trọng để dự đoán phản ứng liệu pháp miễn dịch, đại diện cho tổng số đột biến hiện diện trong bộ gen của khối u.
TMB cao thường chỉ ra khả năng lớn hơn trong tạo ra neo kháng nguyên.
Đó là những protein mới có thể được hệ miễn dịch nhận ra như chất lạ khiến các khối u này dễ bị tổn thương hơn trước các can thiệp liệu pháp miễn dịch.
Tuy nhiên, đo lường và diễn giải TMB một cách chính xác đòi hỏi các phương pháp phân tích tinh vi có thể xử lý sự phức tạp và biến đổi vốn có trong dữ liệu gen.
AI hiện đại hóa phân tích TMB qua cung cấp các phương pháp tự động, tiêu chuẩn hóa và có độ chính xác cao để định lượng gánh nặng đột biến trên các loại khối u và bối cảnh gen khác nhau.
Các thuật toán học máy có thể xử lý dữ liệu giải trình tự thô, xác định các đột biến thực sự trong khi lọc bỏ các tạo tác kỹ thuật và tính toán điểm TMB vừa có ý nghĩa lâm sàng vừa có thể tái tạo.
Những hệ thống được hỗ trợ bởi AI này cũng có thể tính đến các yếu tố như độ sâu giải trình tự, tính đồng nhất của phạm vi và thiên lệch đặc thù của nền tảng mà truyền thống làm phức tạp thêm.
Ví dụ: Công ty Tempus đã triển khai hệ thống AI xTMB giúp phân tích TMB chính xác hơn 95% so với phương pháp truyền thống, giúp bác sĩ lựa chọn đúng bệnh nhân để điều trị bằng Pembrolizumab – loại thuốc miễn dịch đắt tiền nhưng hiệu quả cao.
Tác động lâm sàng của phân tích TMB được tăng cường bởi AI mở rộng vượt ra ngoài mục tiêu đếm đột biến đơn giản để bao gồm diễn giải tinh vi về gánh nặng đột biến trong bối cảnh đặc điểm bệnh nhân cá thể và lịch sử điều trị.
Các mô hình AI có thể tích hợp dữ liệu TMB với các biến lâm sàng khác để tạo ra điểm dự đoán toàn diện hướng dẫn lựa chọn liệu pháp miễn dịch và quyết định liều dùng.
Cách tiếp cận này đảm bảo cho bệnh nhân có khối u TMB cao nhận được can thiệp liệu pháp miễn dịch thích hợp trong khi tránh tiếp xúc điều trị không cần thiết cho những người không có khả năng hưởng lợi.
Do đó tối ưu hóa cả hiệu quả điều trị và an toàn cho bệnh nhân.
Phân tích Neo kháng nguyên
Neo kháng nguyên đại diện cho có lẽ những mục tiêu hứa hẹn nhất cho liệu pháp miễn dịch ung thư cá nhân hóa, vì những protein đặc thù khối u này có mặt độc nhất trong các tế bào ung thư và không có trong mô bình thường.
Khám phá và mô tả đặc điểm của neo kháng nguyên đòi hỏi sự tích hợp dữ liệu gen, phiên mã và miễn dịch học để xác định các đột biến tạo ra các protein mới có khả năng gây ra phản ứng miễn dịch.
Quá trình này liên quan đến dự đoán protein đột biến nào sẽ được xử lý và trình diện đúng cách bởi các tế bào miễn dịch.
Đây là một thách thức tính toán phức tạp hưởng lợi rất nhiều từ các phương pháp AI.
Thuật toán AI vượt trội trong dự đoán neo kháng nguyên qua khả năng đồng thời phân tích nhiều yếu tố ảnh hưởng đến nhận biết miễn dịch.
Đó là ái lực liên kết peptide với phân tử MHC, mô hình cắt proteasomal, và tiềm năng nhận biết receptor tế bào T.
Các mô hình học máy được huấn luyện trên bộ dữ liệu lớn về tương tác miễn dịch đã biết có thể dự đoán với độ chính xác đáng kể neo kháng nguyên nào có khả năng tạo ra phản ứng miễn dịch hiệu quả nhất.
Những hệ thống AI này cũng có thể tính đến các yếu tố đặc thù bệnh nhân như loại HLA và kho miễn dịch hiện có để cá nhân hóa dự đoán neo kháng nguyên cho từng bệnh nhân.
Ví dụ: Nghiên cứu tại Bệnh viện đã sử dụng AI để xác định neo kháng nguyên cá nhân hóa cho 200 bệnh nhân ung thư phổi, tạo ra vaccine cá thể giúp 67% bệnh nhân có phản ứng miễn dịch tích cực và kéo dài thời gian sống thêm trung bình 8.3 tháng.
Ý nghĩa điều trị của khám phá neo kháng nguyên dựa trên AI là biến đổi cho điều trị ung thư.
Khi xác định các neo kháng nguyên có tính miễn dịch cao nhất cho mỗi bệnh nhân, AI tạo điều kiện phát triển vaccine cá nhân hóa và liệu pháp tế bào được thiết kế riêng để nhắm mục tiêu hồ sơ kháng nguyên độc đáo của mỗi khối u.
Cách tiếp cận chính xác này tối đa hóa khả năng tạo ra miễn dịch chống khối u hiệu quả trong khi tối thiểu hóa nguy cơ phản ứng tự miễn.
Điều này đại diện cho sự chuyển đổi mô hình hướng tới liệu pháp miễn dịch ung thư thực sự cá nhân hóa.

Mô tả đặc điểm vi môi trường miễn dịch
Vi môi trường miễn dịch đại diện cho hệ sinh thái phức tạp của các tế bào miễn dịch và không miễn dịch xung quanh khối u phổi.
Nó đóng vai trò quyết định trong xác định kết quả điều trị và tiến triển bệnh.
Vi môi trường này bao gồm các loại tế bào khác nhau như tế bào T, tế bào B, tế bào diệt tự nhiên, đại thực bào, tế bào dendritic và nguyên bào sợi.
Mỗi loại đóng góp vào miễn dịch chống khối u hoặc ức chế miễn dịch.
Thông tin về thành phần, tổ chức và trạng thái chức năng của các thành phần tế bào này là cần thiết để dự đoán phản ứng điều trị và thiết kế can thiệp điều trị hiệu quả.
Công nghệ AI cung cấp khả năng chưa từng có cho phân tích vi môi trường miễn dịch qua xử lý dữ liệu đa chiều từ các kỹ thuật như giải trình tự RNA tế bào đơn, nhuộm miễn dịch đa plex và phiên mã không gian.
Các thuật toán học máy có thể xác định các quần thể tế bào riêng biệt.
Sau đó mô tả đặc điểm trạng thái chức năng của chúng và lập bản đồ mối quan hệ không gian của chúng trong vi môi trường khối u.
Những phân tích được hỗ trợ bởi AI này tiết lộ tương tác tế bào và mạng lưới giao tiếp chưa được nhận biết trước đây ảnh hưởng đến phản ứng miễn dịch, cung cấp hiểu biết chi tiết về cơ chế kích hoạt và ức chế miễn dịch.
Ví dụ: Nghiên cứu sử dụng công nghệ CyTOF kết hợp AI đã phát hiện ra một phân nhóm tế bào T CD8+ mới (gọi là “siêu chiến binh miễn dịch”) chỉ có mặt ở 15% bệnh nhân ung thư phổi nhưng quyết định 85% khả năng đáp ứng với liệu pháp anti-PD1.
Ứng dụng lâm sàng của phân tích vi môi trường miễn dịch dựa trên AI rất rộng rãi và tác động trực tiếp đến chăm sóc bệnh nhân.
Qua mô tả đặc điểm cảnh quan miễn dịch của các khối u cá thể, AI có thể dự đoán bệnh nhân nào có khả năng đáp ứng nhất với các phương pháp liệu pháp miễn dịch cụ thể.
Từ đó xác định chiến lược liệu pháp kết hợp tối ưu, và giám sát các thay đổi chức năng miễn dịch do điều trị gây ra.
Hiểu biết toàn diện về vi môi trường miễn dịch này giúp các bác sĩ lâm sàng đưa ra quyết định điều trị chính xác được điều chỉnh chính xác theo hồ sơ miễn dịch học của từng bệnh nhân.
Do đó cải thiện kết quả điều trị và chất lượng cuộc sống cho bệnh nhân.
Nghiên cứu protein ung thư phổi
Vai trò protein trong sinh học ung thư
Proteomics nghiên cứu toàn diện về các protein được biểu hiện trong hệ thống sinh học là một trong những lĩnh vực triển vọng nhất để áp dụng AI trong nghiên cứu ung thư phổi.
Tầm quan trọng của lĩnh vực này nằm ở khả năng nắm bắt trạng thái chức năng động của tế bào ung thư vì protein đóng vai trò là những “người thực thi” chính các quá trình sinh học và thường là mục tiêu trực tiếp của các can thiệp điều trị.
Ví dụ: Khi một bệnh nhân ung thư phổi được chẩn đoán, các bác sĩ thường kiểm tra protein PD-L1 để quyết định có nên sử dụng liệu pháp miễn dịch hay không.
Tuy nhiên, AI có thể phân tích hàng nghìn protein khác nhau cùng lúc để đưa ra quyết định chính xác hơn.
Nhận diện mẫu hình do AI điều khiển
Thuật toán AI vượt trội trong khả năngphân tích sự phức tạp khổng lồ của dữ liệu protein.
Đó là nơi hàng nghìn protein với mức độ biểu hiện khác nhau tạo ra các mẫu hình phức tạp mà các nhà nghiên cứu con người không thể giải mã thủ công.
Các mô hình học máy có thể xác định những dấu hiệu biểu hiện protein tinh tế giúp phân biệt giữa các phân loại, giai đoạn và phản ứng điều trị khác nhau của ung thư phổi.
Những phân tích do AI điều khiển này đã khám phá ra các bảng chỉ số sinh học mới cải thiện đáng kể độ chính xác chẩn đoán so với các chỉ số protein đơn lẻ truyền thống.
Ví dụ: Thay vì chỉ xem xét một protein như CEA, AI có thể đồng thời phân tích 50-100 protein khác nhau để tạo ra một “dấu vân tay protein” độc nhất cho từng bệnh nhân, giống như cách Netflix gợi ý phim dựa trên nhiều yếu tố thay vì chỉ một thể loại.
Ý nghĩa thực tiễn của protein được tăng cường bằng AI vượt xa nghiên cứu cơ bản.
Các ứng dụng lâm sàng bao gồm phát triển các xét nghiệm chẩn đoán chính xác hơn, xác định mục tiêu điều trị và dự đoán phản ứng điều trị.
Các mô hình AI được huấn luyện trên dữ liệu protein có thể dự đoán bệnh nhân nào có khả năng phản ứng tốt nhất với các liệu pháp miễn dịch cụ thể.
Do đó giúp các bác sĩ lâm sàng đưa ra quyết định điều trị có căn cứ hơn và tránh các tác dụng phụ không cần thiết từ những phương pháp điều trị không hiệu quả.

Nghiên cứu chuyển hóa ung thư phổi
Phân tích sinh hóa tế bào ung thư
Nghiên cứu chuyển hóa là nghiên cứu về các phân tử nhỏ và con đường trao đổi chất trong hệ thống sinh học.
Phương pháp này cung cấp những thông tin chi tiết về trạng thái sinh hóa thời gian thực của tế bào ung thư phổi.
Vì thế chúng đặc biệt có giá trị vì những thay đổi trao đổi chất thường xảy ra sớm trong quá trình phát triển ung thư và có thể phản ánh cả những thay đổi di truyền lẫn ảnh hưởng môi trường lên hành vi khối u.
Ví dụ: Tế bào ung thư phổi thường tiêu thụ glucose nhiều hơn tế bào bình thường (hiện tượng Warburg).
AI có thể phát hiện những thay đổi trao đổi chất tinh vi khác mà mắt thường không nhận ra, như sự thay đổi trong quá trình tổng hợp acid amin hoặc lipid.
Phân tích mạng lưới trao đổi chất
Ứng dụng AI vào dữ liệu chuyển hóa giải quyết sự phức tạp vốn có của các mạng lưới trao đổi chất.
Đây là nơi hàng trăm con đường liên kết với nhau tạo ra một mạng lưới các mối quan hệ sinh hóa.
Các phương pháp thống kê truyền thống thường không nắm bắt được những tương tác phức tạp này nhưng thuật toán AI có thể xác định những dấu hiệu trao đổi chất tương quan với tiến triển bệnh, tiềm năng di căn và kháng thuốc điều trị.
Các mô hình học máy đã thành công trong phân biệt giữa tổn thương phổi lành tính và ác tính chỉ dựa trên hồ sơ trao đổi chất.
Từ đó mở ra tiềm năng cho các phương pháp chẩn đoán không xâm lấn.
Hơn nữa, nghiên cứu chuyển hóa do AI điều khiển đang thay đổi những hiểu biết của con người về cách tế bào ung thư phổi điều chỉnh quá trình trao đổi chất để tồn tại trong môi trường khắc nghiệt.
Những hiểu biết này dẫn đến xác định những điểm yếu trao đổi chất có thể trở thành mục tiêu điều trị.
Vì vậy mở ra những hướng điều trị mới khai thác những phụ thuộc trao đổi chất đặc trưng của ung thư trong khi bảo vệ mô bình thường.

Nghiên cứu vi sinh học ung thư phổi
Mô hình mới về vi sinh học
Lĩnh vực vi sinh học mới trong nghiên cứu ung thư phổi tập trung vào hiểu cách các cộng đồng vi sinh vật trong đường hô hấp ảnh hưởng đến sự phát triển, tiến triển và phản ứng điều trị của ung thư.
Lĩnh vực tương đối mới này thách thức quan điểm truyền thống về phổi như những cơ quan vô trùng.
Từ đó tiết lộ những tương tác phức tạp giữa miễn dịch vật chủ, quần thể vi sinh vật và sinh học ung thư.
Ví dụ: Nghiên cứu gần đây phát hiện ra rằng bệnh nhân ung thư phổi có vi sinh phổi khác biệt so với người khỏe mạnh.
Một số vi khuẩn như Veillonella có thể thúc đẩy viêm và phát triển ung thư, trong khi những loại khác lại có thể tăng cường phản ứng miễn dịch chống khối u.
Phân tích độ phức tạp cộng đồng vi sinh vật
Ứng dụng AI trong vi sinh học đặc biệt mạnh mẽ vì chúng có thể xử lý và phân tích những bộ dữ liệu khổng lồ được tạo ra từ công nghệ giải trình tự thế hệ mới dùng để đặc trưng hóa các cộng đồng vi sinh vật.
Thuật toán học máy có thể xác định những dấu hiệu vi sinh vật cụ thể liên quan đến các phân đoạn và giai đoạn ung thư phổi khác nhau.
Chúng cũng có thể dự đoán kết quả điều trị dựa trên thành phần vi sinh cơ bản.
Những phân tích này đã tiết lộ rằng một số loài vi khuẩn có thể thúc đẩy phát triển ung thư thông qua viêm mãn tính, trong khi những loài khác có thể tăng cường phản ứng miễn dịch chống khối u.
Tiềm năng lâm sàng của vi sinh học được tăng cường bằng AI bao gồm phát triển các công cụ chẩn đoán và can thiệp điều trị dựa trên vi sinh.
Các nhà nghiên cứu đang khám phá cách điều chỉnh vi sinh phổi thông qua các liệu pháp có mục tiêu hoặc men vi sinh có thể cải thiện hiệu quả điều trị.
Điều này đặc biệt cần thiết đối với các liệu pháp miễn dịch nơi vi sinh đóng vai trò quan trọng trong kích hoạt và chức năng hệ miễn dịch.

Nghiên cứu X quang ung thư phổi
Phân tích hình ảnh định lượng
Nghiên cứu X-quang đại diện cho một trong những ứng dụng trưởng thành nhất của AI trong ung thư phổi.
Khi đó AI tập trung vào trích xuất và phân tích các đặc trưng định lượng từ dữ liệu hình ảnh y khoa mà mắt người không thể nhìn thấy.
Phương pháp này biến đổi các phương thức hình ảnh tiêu chuẩn như chụp CT, MRI và PET thành những nguồn thông tin sinh học phong phú về đặc tính và hành vi của khối u.
Ví dụ: Trong khi bác sĩ X-quang chỉ có thể nhìn thấy một nốt phổi tròn trên phim chụp, AI có thể phân tích hàng trăm đặc điểm như độ mịn bề mặt, mật độ bên trong, và mẫu hình kết cấu.
Từ đó AI có thể dự đoán khối u này có ác tính hay không với độ chính xác lên đến 90%.
Trích xuất đặc trưng nâng cao
Thuật toán AI trong X quang có thể phân tích hàng trăm đặc trưng về kết cấu, hình dạng và cường độ trong các nốt và khối u phổi.
Sau đó tạo ra những hồ sơ định lượng chi tiết phản ánh sinh học khối u cơ bản.
Những dấu hiệu này có thể dự đoán các kết quả lâm sàng quan trọng như xác suất ác tính, phân loại mô học, trạng thái đột biến và phản ứng điều trị với độ chính xác đáng chú ý.
Bản chất không xâm lấn của X-quang khiến nó đặc biệt có giá trị trong theo dõi tiến triển bệnh và hiệu quả điều trị theo thời gian.
Tích hợp AI với X quang đang thúc đẩy phát triển các hệ thống chẩn đoán hỗ trợ máy tính có thể giúp các bác sĩ X-quang đưa ra những diễn giải chính xác và nhất quán hơn về các nghiên cứu hình ảnh phổi.
Những hệ thống này đặc biệt có giá trị trong các cơ sở y tế có hạn chế tiếp cận chuyên môn chuyên khoa.
Vì vậy mở rộng khả năng tiếp cận chẩn đoán chất lượng cao và có khả năng giảm thiểu sự chênh lệch chăm sóc sức khỏe giữa thành thị và nông thôn.
Nghiên cứu bệnh học ung thư phổi
Bệnh lý số hóa trong phân tích mô học
Ứng dụng AI vào hình ảnh bệnh lý số đại diện cho sự hội tụ giữa chuyên môn giải phẫu bệnh truyền thống với khả năng tính toán tiên tiến.
Lĩnh vực này đang biến đổi cách các nhà giải phẫu bệnh phân tích mẫu mô ung thư phổi thông qua trích xuất các đặc trưng định lượng từ hình ảnh vi thể độ phân giải cao.
Do dó giúp chuyên gia y tế nắm bắt các mẫu hình tế bào và kiến trúc liên quan đến các loại và hành vi ung thư khác nhau.
Ví dụ: Thay vì chỉ quan sát “tế bào có vẻ bất thường” dưới kính hiển vi, AI có thể đo đạc chính xác kích thước, hình dạng nhân tế bào và mật độ tế bào.
Sau đó AI so sánh với cơ sở dữ liệu hàng nghìn trường hợp để đưa ra chẩn đoán chính xác hơn.
Phân tích đặc trưng hình thái và mẫu hình
Các mô hình AI trong bệnh học có thể xác định những đặc trưng hình thái tinh tế trong mô ung thư phổi tương quan với đặc tính phân tử, tiên lượng và phản ứng điều trị.
Những thuật toán này có thể phân tích mật độ tế bào, hình thái nhân tế bào, kiến trúc mô và mối quan hệ không gian giữa các loại tế bào khác nhau với độ chính xác và nhất quán chưa từng có.
Khả năng định lượng những đặc trưng này một cách khách quan làm giảm sự biến đổi giữa các quan sát viên và tăng cường tính tái lập của chẩn đoán bệnh lý.
Các ứng dụng lâm sàng của nghiên cứu bệnh học do AI điều khiển đang mở rộng nhanh chóng.
Đó là phân độ khối u tự động, dự đoán thay đổi phân tử và xác định bệnh nhân có thể hưởng lợi từ các liệu pháp nhắm mục tiêu cụ thể.
Khi tích hợp với dữ liệu omics khác tạo ra những chân dung phân tử toàn diện của từng khối u riêng lẻ.
Từ đó tạo điều kiện cho các phương pháp điều trị thực sự cá nhân hóa vì đã xem xét cả đặc tính hình thái và phân tử của khối u.
Có thể bạn quan tâm

Liên hệ

Địa chỉ
Tầng 3 Toà nhà VNCC
243A Đê La Thành Str
Q. Đống Đa-TP. Hà Nội

info@comlink.com.vn

Phone
+84 98 58 58 247











